
ГОСУДАРСТВЕННАЯ СИСТЕМА
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОГО
НОРМИРОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
2.1.4. ПИТЬЕВАЯ ВОДА И ВОДОСНАБЖЕНИЕ
НАСЕЛЕННЫХ МЕСТ
ОРГАНИЗАЦИЯ ВНУТРЕННЕГО КОНТРОЛЯ
КАЧЕСТВА САНИТАРНО-МИКРОБИОЛОГИЧЕСКИХ
ИССЛЕДОВАНИЙ ВОДЫ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
МУ 2.1.4.1057-01
МИНЗДРАВ РОССИИ
Москва
1. РАЗРАБОТАНЫ Федеральным центром Госсанэпиднадзора Минздрава России (Л.Г. Подунова, Н.С. Кривопалова, Р.С. Сорокина), Аналитическим центром контроля качества воды ЗАО «Роса» (Г.П. Кашкарова, Е.Н. Ахапкина, С.Н. Тымчук, А.И. Дородников, А.В. Карташова, В.Е. Ларин), Федеральным научным центром гигиены им. Ф.Ф. Эрисмана (Г.М. Трухина), Центром Госсанэпиднадзора в Тульской области (Т.А. Попова).
2. УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации Г.Г. Онищенко 6 июля 2001 г.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
СОДЕРЖАНИЕ
УТВЕРЖДАЮ
Главный государственный санитарный
врач Российской Федерации -
Первый заместитель Министра
здравоохранения Российской Федерации
Г. Г. Онищенко
6 июля 2001 г.
МУ 2.1.4.1057-01
Дата введения 1 октября 2001 г.
2.1.4. ПИТЬЕВАЯ ВОДА И ВОДОСНАБЖЕНИЕ НАСЕЛЕННЫХ МЕСТ
Организация внутреннего контроля
качества санитарно-микробиологических
исследований воды
Методические указания
1. Область применения
Методические указания «Организация внутреннего контроля качества санитарно-микробиологических исследований воды» (далее - методические указания) предназначены для лабораторий, выполняющих санитарно-микробиологические исследования воды при обеспечении государственного санитарно-эпидемиологического и производственного контроля качества воды: питьевого, хозяйственно-бытового водоснабжения, водных объектов рекреации, спорта и др.
Настоящие методические указания являются первым опытом обобщения научных данных и практических рекомендаций международных и отечественных документов в этой области, а также результатов их использования в производственных условиях.
Авторы рассматривают представленный документ как один из этапов совершенствования организации внутреннего контроля в отношении качества микробиологических исследований.
Методические указания представляют собой свод отдельных методик и процедур контроля качества, выполняемых на различных этапах микробиологических исследований, и направлены на их унификацию в целях получения надежных и сопоставимых результатов анализа.
Данные методические указания являются обязательными для выполнения лабораториями, аккредитованными (аттестованными) на проведение санитарно-микробиологических исследований воды. Руководство по качеству аккредитованной испытательной лаборатории должно включать или иметь ссылки на процедуры, описанные в методических указаниях.
Документальное представление результатов выполнения методик и процедур, содержащихся в методических указаниях, является неотъемлемой частью при подтверждении технической компетенции лабораторий, аккредитуемых в области микробиологических исследований воды.
2. Нормативные ссылки
1. ГОСТ 18963-73 «Вода питьевая. Методы санитарно-бактериологического анализа».
2. ГОСТ 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов».
3. ГОСТ Р ISO/МЭК 17025-2000 «Общие требования к компетентности испытательных и калибровочных лабораторий».
4. ГОСТ Р 51446-99 (ИСО 7218-96) «Микробиология. Продукты пищевые. Общие правила микробиологических исследований».
5. XI Государственная Фармакопея СССР. - М., 1998.
6. Инструкции по микробиологическому контролю производства на предприятиях молочной промышленности. - М., 1987.
7. Методические рекомендации к контролю питательных сред по биологическим показателям. - МЗ СССР. - М., 1980.
8. Методические рекомендации по контролю стерилизации с использованием индикаторов стерилизации НПФ «Винар» № 11-8\03-54 от 11.06.93. - МЗ РФ.
9. МУ 2.1.4.682-97. Методические указания по внедрению и применению санитарных правил и норм СанПиН 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
10. МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды».
11. МУК 4.2.557-96 «Методы микробиологического контроля продуктов детского питания и лечебного, их компонентов».
12. МУК 4.2.734-99 «Микробиологический мониторинг производственной среды».
13. ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы». - МЗ СССР, 1985.
14. Приказ № 720 Минздрава СССР от 31 июля 1978 г., п. 4 «Мероприятия, обеспечивающие асептические условия при посевах».
15. Приказ Минздрава РФ от 07.02.00 № 45 «О системе мер по повышению качества клинических лабораторных исследований в учреждениях здравоохранения Российской Федерации».
16. Руководство Министерства здравоохранения Российской Федерации Р 3.1.683-98 «Использование ультрафиолетового излучения для обеззараживания воздуха и поверхностей в помещениях». - М., 1998.
17. Руководство 2.2.755-99 «Гигиенические критерии оценки и классификации условий труда по показателям вредности и опасности факторов производственной среды, тяжести и напряженности трудового процесса».
18. Сборник инструкций по общим методам контроля стерильности, физико-химических свойств, пирогенности, на отсутствие контаминирующих агентов и токсичности медицинских иммунобиологических препаратов. Утв. приказом МЗ СССР № 31 от 13.01.83.
19. Система аккредитации испытательных лабораторий (центров) государственной санитарно-эпидемиологической службы Российской Федерации. - М., 1997.
20. СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами». - М., 1999.
21. СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I-IV групп патогенности». - М., 1996.
22. ФС 42-3377-97 «Питательный агар для культивирования микроорганизмов сухой (ГРМ - агар)».
23. ФС 42-3378-97 «Питательный бульон для культивирования микроорганизмов сухой (ГРМ - бульон)».
24. ФС 42-3504-97 «Питательная среда для выделения энтеро-бактерий сухая (агар Эндо)».
25. ФС 42-3588-98 «Питательная среда для выделения сальмонелл сухая (висмут-сульфит агар)».
Использованные документы международного уровня указаны в разделе «Библиография».
3. Термины и определения
1. Бокс (боксированное помещение) - изолированное помещение с тамбуром (предбоксником).
2. Бокс биологической безопасности (ламинарное укрытие, ламинарный шкаф) - конструкция, используемая для физической изоляции (удержания и контролируемого удаления из рабочей зоны) микроорганизмов с целью предотвращения возможности заражения персонала и контаминации воздуха рабочей зоны и окружающей среды.
3. Запас рабочей культуры - культура эталонного штамма в условиях временного хранения (полужидкий агар, 4 - 8 °С).
4. Запас эталонной культуры - культура эталонного штамма в условиях длительного хранения (-70 °С, жидкий азот).
5. Культура для целевого использования - культура эталонного штамма, прошедшая не более 2 пассажей после высева со среды временного хранения (из запасов рабочей культуры), предназначенная для использования в анализе.
6. Лиофилизированная культура - лиофильно высушенная культура эталонного штамма.
7. Патогенные биологические агенты (ПБА) - патогенные для человека микроорганизмы (бактерии, вирусы, хламидии, риккетсии, простейшие, грибы, микоплазмы), генно-инженерно-модифицированные микроорганизмы, яды биологического происхождения (токсины), гельминты, а также материал, подозрительный на содержание перечисленных агентов (включая кровь, другие биологические жидкости и объекты окружающей среды).
8. Посевная - рабочее помещение, предназначенное для выполнения первого этапа санитарно-микробиологического исследования воды: концентрирования, разведения и/или посева в питательные среды.
9. Посевная доза - объем конкретного разведения, содержащий необходимое для посева количество жизнеспособных клеток тестового микроорганизма.
10. Разбавитель - жидкость определенного состава, служащая для приготовления серийных разведений исследуемой воды или модельных бактериальных культур.
11. Субкультура - культура бактерий, полученная путем пассажа через полноценные питательные среды.
4. Общие положения организации внутреннего контроля качества санитарно-микробиологического исследования воды
Ведущим аспектом деятельности современной лаборатории является разработка Системы качества и обеспечение ее функционирования.
Система качества - это совокупность организационной структуры, методик, процессов и ресурсов, необходимых для осуществления общего руководства качеством (ISO 8401: 1994-04-01).
Система качества охватывает широкий спектр позиций, начиная от нормативно-методической документации, всесторонне регламентирующей деятельность лаборатории, ее планировки и технического оснащения, квалификации, численности и расстановки кадров - до организации внутреннего контроля качества выполняемых анализов.
Согласно МУ 2.1.4.682-97 по внедрению и применению СанПиН 2.1.4.559-96, внутрилабораторный (внутренний) контроль качества является обязательным звеном в обеспечении качества исследований воды.
Внутренний контроль качества микробиологических исследований - это комплекс выполняемых лабораторией мероприятий и процедур, направленных на обеспечение и контроль стабильности требуемых условий развития искомого микроорганизма, а также предупреждение неблагоприятного воздействия факторов, возникающих в процессе подготовки, выполнения и оценки результатов анализа, способных повлиять на достоверность результата.
Особенностью санитарно-микробиологических исследований воды является необходимость количественной оценки полученного результата.
Специфика объекта микробиологических исследований, живого микроорганизма, обладающего индивидуальными (родовыми, видовыми, штаммовыми) свойствами и особенностями жизнедеятельности в условиях водной среды, создает независящие от исследователя проблемы в оценке точности количественного результата и обусловливает погрешность микробиологических методов, достигающую сотен процентов.
К наиболее значимым объективным факторам, влияющим на результат анализа, относятся следующие:
· Неравномерность распределения микроорганизмов, обусловливающая разброс данных при анализе двух одинаковых объемов одной пробы воды.
· Способность адсорбироваться на взвешенных веществах с образованием трудноразделимых в процессе взбалтывания комплексов, которые при посевах могут регистрироваться как один микроорганизм.
· Влияние сопутствующих микробов-антагонистов, тормозящих развитие искомых микроорганизмов при их наличии в анализируемой пробе воды.
· Возможное присутствие в исследуемой воде посторонних химических веществ либо образование их соединений с компонентами питательной среды, которые могут угнетать/стимулировать/рост исследуемых микроорганизмов, а также влиять на изменение видовых биохимических идентификационных признаков.
· Нахождение микроорганизма в «стрессовом» состоянии под воздействием неблагоприятных условий водной среды, в результате которого затормаживается его способность к развитию.
· Исходя из этого, основной задачей микробиологических исследований является создание оптимальных условий для развития выделяемого микроорганизма в целях получения надежных, сопоставимых количественных результатов.
· Организация внутреннего контроля качества на всех этапах выполнения микробиологического анализа воды является основной получения качественного результата.
Основные направления организации внутреннего контроля качества:
1. Контроль за соблюдением требований к условиям проведения анализа: (лабораторные помещения, воздушная среда, температурные режимы инкубации и хранения, режимы дезинфекции и стерилизации и т.д.).
2. Выполнение регламентированных процедур ведения тестовых культур.
3. Контроль качества питательных сред.
4. Контроль качества мембранных фильтров.
5. Контроль качества дистиллированной воды.
6. Оценка достоверности качественного результата путем использования заведомо положительных и отрицательных контролей.
7. Оценка доверительных границ полученного количественного результата.
8. Систематический анализ результатов контрольных процедур в целях совершенствования руководства по качеству.
Структура организации внутреннего контроля качества, периодичность и частота выполняемых процедур представлены в прил. 1, 2.
Описание процедур контроля соблюдения требований к условиям проведения анализа, ведения эталонных бактериальных культур, контроля качества питательных сред и мембранных фильтров, постановки положительных и отрицательных контролей и др. представлены в тексте методических указаний и иллюстрированы в приложениях.
Документальное оформление результатов проведенных контрольных процедур осуществляется в произвольной форме, удобной исполнителю и наглядной для других специалистов, привлекаемых к участию в различных комиссиях по проверке работы лаборатории (по аттестации, аккредитации и др.). При этом могут быть использованы журнальные формы учета или формы отдельных контрольных листов, которые впоследствии брошюруются за определенный период времени (месяц, квартал, год) в зависимости от кратности и вида контроля.
Регистрация и хранение контрольных результатов могут осуществляться на электронных носителях.
Приведенные в приложении к методическим указаниям некоторые учетные формы носят информационный характер и даны в качестве возможного варианта учета результатов. Исключение составляют прил. 4 и 8.1, в которых приведены формы учета, утвержденные Минздравом России.
В информационном прил. 11 представлен перечень современного оборудования, применение которого будет способствовать повышению качества выполняемых санитарно-микробиологических исследований воды и надежности получаемых результатов.
Обязательным разделом внутреннего контроля качества является проведение периодического, но не реже 1 раза в год, анализа результатов выполненных контрольных процедур, с учетом которого осуществляется корректировка руководства по качеству испытательной лаборатории.
Обеспечение качества выполняемых исследований возможно только при наличии квалифицированного персонала. К работе по выполнению санитарно-микробиологических анализов воды допускаются специалисты с высшим и средним специальным медицинским/биологическим (микробиологическим) образованием, проходящие не реже 1 раза в пять лет курс повышения квалификации в объеме, определенном Минздравом России для бактериологов, с выдачей удостоверения установленного образца.
Требования к набору помещений и их размещению, организации и безопасности работ микробиологических лабораторий с патогенными биологическими агентами изложены в санитарных правилах «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами». СП 1.2.731-99.
Требования к процедурам выполнения исследований и метрологическому обеспечению оборудования представлены в соответствующих нормативных документах и не являются предметом рассмотрения данных методических указаний.
Вопрос оценки достоверности количественных результатов микробиологических исследований воды на сегодняшний день в России остается не решенным. Действующий ГОСТ 27384-87, представляющий нормы погрешностей для бактериологических исследований воды, не обеспечивает возможности оценки получаемых результатов, так как входит в противоречие с реальными методиками анализа.
В случае возникновения проблем сопоставимости и достоверности результатов санитарно-микробиологических исследований воды ориентировочную оценку можно получить обращением к табл. ГОСТ 51446-99 «Продукты пищевые. Общие правила микробиологических исследований», разработанного на основе международного документа ИСО 7218-96.
5. Контроль температурных режимов инкубации и хранения
5.1. Процедура контроля температуры в термостатах
Контроль температуры в термостатах проводят ежедневно перед началом работы.
Для контроля используют проверенные термометры.
Цена деления термометра не должна превышать половины величины допустимого отклонения температуры инкубации, определенного нормативно-методической документацией. Например: для температуры 37 °С допустимое отклонение температуры составляет ±1 °С. Для контроля температуры в термостате, поддерживающем данную температуру, необходимо использовать термометры с ценой деления не более 0,5 °С. Соответственно, для температуры 44 °С, при допустимом отклонении температуры ±0,5 °С, цена деления контрольного термометра не должна превышать 0,25 °С.
Подготовительный этап
Для устранения искажения показаний термометра из-за быстрого изменения температуры в термостате при открывании дверцы, термометр помещают в пробирку с глицерином либо с расплавленным парафином. После застывания парафина подготовленный термометр можно размещать в горизонтальном положении.
Методика контроля
Термометр размещают в центре камеры. При выявлении в процессе аттестации термостата экстремальных точек, термометры размещают в экстремальных точках.
Ежедневно перед началом работы снимают показания контрольного термометра, результаты измерений заносят в журнал (контрольный лист) и заверяют подписью исполнителя (прил. 3).
В журнале для каждого термостата должно быть отмечено допустимое отклонение температуры с учетом требований методов, для исполнения которых используется конкретный термостат.
В случае превышения допустимых отклонений температуры сотрудник, проводящий регистрацию, должен немедленно сообщить об этом руководителю подразделения для принятия мер.
5.2. Процедура контроля температуры в холодильниках
Контроль температуры в холодильниках проводят один раз в неделю. Температура в холодильнике должна быть в пределах (4 - 8) °С. Для контроля используют проверенные термометры, подготовленные как указано в п. 5.1.
Методика контроля
Термометр помещают в центр камеры холодильника.
Один раз в неделю перед началом работы снимают показания контрольных термометров, результаты измерений заносят в журнал (контрольный лист) и заверяют подписью исполнителя (прил. 3).
В случае превышения допустимых отклонений температуры сотрудник, проводящий регистрацию, должен поставить в известность руководителя подразделения и провести регулировку для компенсации выявленных отклонений. Регулировку проводят переводом регулятора температуры холодильника в нужное положение. После приведения температуры до уровней допустимых значений, двукратно, через 4 часа и на следующий день, проводят регистрацию температуры.
После приведения к норме режима работы холодильника переходят к обычной схеме контроля температуры.
6. Контроль качества стерилизации и дезинфекции
6.1. Процедура контроля режимов паровой и суховоздушной стерилизации
Для контроля режимов стерилизации необходимо использовать три вида контроля.
Термический и химический контроль режима стерилизации проводится оператором парового стерилизатора, прошедшим курс специальной подготовки по безопасной эксплуатации автоклавов.
Биологический контроль осуществляется бактериологом лаборатории, проводящей санитарно-бактериологические исследования воды, или дезинфекционными станциями по заказу лаборатории.
|
Вид контроля |
Кратность контроля |
|
Химический |
Каждый цикл стерилизации |
|
Термический |
1 раз в 2 недели |
|
Биологический |
2 раза в год |
Обо всех случаях неудовлетворительного прохождения какого-либо из видов контроля стерилизации ответственный исполнитель информирует руководителя подразделения.
При неудовлетворительном прохождении контроля использование всей партии материалов запрещается. Материал требует повторной обработки. Для выяснения причин неудовлетворительной работы стерилизатор не используется.
Причину неудовлетворительной работы стерилизаторов устанавливают представители «Медтехники» или технических служб предприятия. После устранения причины процедуру контроля работы стерилизатора повторяют.
6.1.1. Химический тестовый контроль
Химический контроль проводят при каждом рабочем цикле. Для контроля используют бумажные индикаторы стерилизации (НПО «Винар») или тестовые химические вещества, рекомендованные в прил. 7.6 Санитарных правил 1.2.731-99.
Методика контроля паровой стерилизации
В контрольных точках рабочей камеры укладывают герметично запаянные ампулы с химическим тестовым веществом или индикаторные полоски ИС длиной 2 - 3 см, которые прикрепляют к стерилизационным коробкам или стерилизуемым изделиям.
Число контрольных точек зависит от емкости камеры.
|
Емкость камеры парового стерилизатора (л) |
Число контрольных точек в стерилизационной камере |
|
100 |
5 |
|
100 - 750 |
11 |
|
Свыше 750 |
13 |
Для стерилизатора объемом до 100 л точки 1 и 2 находятся: для горизонтального автоклава 1-я - у загрузочной двери, 2-я - у противоположной стенки, для вертикального автоклава - в верхней и нижней части камеры, соответственно. В точках 1 и 2 тесты располагают вне стерилизуемых изделий. В остальных точках тесты располагают в центре стерилизационных коробок или внутри стерилизуемых упаковок.
Для стерилизаторов больших объемов тесты располагают согласно схеме, приводимой в инструкции по использованию индикаторов стерилизации.
Методика контроля суховоздушной стерилизации
В контрольных точках рабочей камеры укладывают герметично запаянные ампулы с химическим тестовым веществом или индикаторные полоски ИС длиной 2 - 3 см, которые прикрепляют к упаковкам или стерилизуемым изделиям.
Число контрольных точек зависит от емкости камеры.
|
Емкость камеры воздушного стерилизатора (л) |
Число контрольных точек в стерилизационной камере |
|
До 80 |
5 |
|
Свыше 80 однокамерные |
15 |
|
Свыше 80 двухкамерные |
30 |
В случае 5 точек - точка 1 располагается в центре камеры, а точки 2, 3, 4 и 5 располагаются в нижней части камеры по углам. Точки 2 и 5 находятся перед загрузочной дверью справа и слева (соответственно), а точки 3 и 4 в глубине камеры у задней стенки также справа и слева.
В случае 15 точек - точки 1, 2 и 3 располагаются в центре камеры на трех уровнях (полках) сверху вниз, соответственно, а точки 4 -15 по углам также на трех уровнях (точки 4 - 7 - низ; точки 8 - 11 - середина; точки 12 - 15 - верх). Угловые точки нумеруются против часовой стрелки, начиная с правого ближнего угла.
В случае 30 точек - расположение как для 15 точек повторяется для каждой камеры.
Каждая контрольная точка должна быть расположена на расстоянии не ближе 5 см от стенок камеры.
Регистрация результатов
По окончании цикла стерилизации ИС (ампулы с химическим тестовым веществом) извлекают из контрольных точек и сравнивают с эталоном. Цвет индикатора стерилизации светлее эталона или нерасплавленный химический тест в пробирке в какой-либо точке указывают на неэффективную стерилизацию. Результаты контроля заносят (вклеивают ИС) в журнал по регистрации режимов стерилизации и заверяют подписью сотрудника, осуществляющего контроль (прил. 4). Один раз в неделю результаты просматриваются и заверяются ответственным бактериологом.
6.1.2. Термический контроль
Термический контроль проводят 2 раза в месяц. Для контроля используют поверенный максимальный термометр с ценой деления не более 1 °С и диапазоном измерений, превышающим контролируемую температуру. Термометр размещают в середине стерилизационной камеры. После окончания цикла стерилизации и остывания термометра до комнатной температуры, снимают показания. Для определения истинного значения максимальной температуры цикла стерилизации к снятому с термометра показанию прибавляют соответствующую поправку, указанную в паспорте на данный термометр.
Результаты заносят в журнал по регистрации режимов стерилизации и заверяют подписями исполнителя и ответственного бактериолога (прил. 4).
6.1.3. Биологический контроль
Биологический контроль осуществляется 2 раза в год. При выполнении биологического контроля используют биотесты, в том числе коммерческие, предназначенные для конкретного вида паровой или суховоздушной стерилизации, разрешенные к применению Минздравом РФ.
Методика контроля
(на примере использования коммерческого набора Испытательного лабораторного
центра Московского городского центра дезинфекции)
Процедуру контроля осуществляют в соответствии с паспортом биотеста. Пронумерованные пакеты с биотестами размещают в контрольных точках стерилизатора. Количество контрольных точек и правила размещения тестов указаны в п. 6.1.1. После завершения процесса стерилизации в пробирки с биотестами асептически вносят 0,5 мл цветной питательной среды, начиная со стерильной пробирки для контроля питательной среды и заканчивая контрольным гестом, не подвергавшимся стерилизации (контроль культуры). Далее осуществляют инкубацию пробирок согласно паспорту на набор.
После термостатирования проводят учет изменения цвета питательной среды. В отрицательном контроле (стерильная пробирка) цвет среды не должен измениться. В пробирке с контролем культуры цвет среды должен измениться на цвет, указанный в паспорте, что свидетельствует о наличии жизнеспособных спор.
Работа парового стерилизатора считается удовлетворительной, если цвет питательной среды во всех биотестах, подвергавшихся стерилизации остался неизменным. Если цвет изменился хотя бы в одном тесте, стерилизация признается неэффективной.
Результаты заносят в журнал по регистрации режимов стерилизации и заверяют подписью исполнителя (прил. 4).
Раздел составлен на основе:
СП 1.2.731-99 «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами»;
Методических рекомендаций по контролю стерилизации с использованием индикаторов стерилизации НПФ «Винар» № 11-8\03-54 от 11.06.93 Министерства здравоохранения Российской Федерации.
6.2. Процедура контроля микробной обсемененности воздуха
В производственных лабораториях бактериологические исследования воздуха на обсемененность предусматривают определение общего содержания микроорганизмов в 1 м3 воздуха.
Контроль воздуха на микробную обсемененность проводят в посевных комнатах, боксах или в ламинарных укрытиях перед началом проведения работ.
Контроль выполняет ответственный исполнитель.
Подготовительный этап
Для контроля используют плотную полноценную неселективную среду (питательный агар, ГРМ-агар и др.) проверенной ранее серии. Проверка среды осуществляется как указано в разделе 11.
Питательный агар разливают в чашки Петри диаметром 90 - 100 мм слоем не менее 2 мм. Для контроля стерильности среды одну чашку из приготовленной и разлитой партии среды инкубируют при температуре 37 °С в течение 24 часов. Учитывают наличие /отсутствие/ пророста среды. При обнаружении роста микроорганизмов среду выбраковывают.
Методика контроля
Контроль воздуха на обсемененность проводят седиментационным или аспирационным методом.
Седиментационный метод
В двух точках посевной комнаты, бокса и (или) ламинарного шкафа ставят открытые чашки Петри с питательным агаром на 15 мин. После экспозиции чашки закрывают, переворачивают и помещают в термостат. Посевы инкубируют при температуре (37 ± 1) °С в течение (24 ± 2) часов. После инкубации проводят учет количества выросших колоний микроорганизмов.
Аспирационный метод
Отбор проб воздуха проводят с помощью пробоотборных устройств для бактериологического анализа, зарегистрированных в Госстандарте Российской Федерации. Отбор пробы воздуха в количестве 100 л проводят согласно инструкции к пробоотборнику. После отбора пробы снимают чашку Петри и термостатируют при температуре (37 ± 1) °С в течение (24 ± 2) часов. После инкубации проводят учет количества выросших колоний микроорганизмов.
Использование аспирационного метода не допускается для контроля воздуха укрытий с ламинарным потоком.
Результат заносят в журнал регистрации микробной обсемененности воздуха и заверяют подписью исполнителя (прил. 5).
Допускается пророст не более 3 колоний на чашке при исследовании седиментационным методом и не выше 500 КОЕ/м3 при использовании аспирационного метода. При превышении указанных уровней общего содержания микроорганизмов немедленно извещают руководителя подразделения. Работы в боксах приостанавливают. Проводят внеплановую генеральную уборку бокса с обработкой всех поверхностей с использованием дезинфицирующих средств и обеззараживанием воздуха ультрафиолетовым облучением. После окончания мероприятий контроль микробной обсемененности воздуха повторяют. При повторном получении неудовлетворительных результатов производят оценку эффективности применения ультрафиолетового бактерицидного излучения для обеззараживания воздуха как указано в разделе 6.4.
Лаборатории центров Госсанэпиднадзора для контроля микробной обсемененности воздуха руководствуются соответствующими приказами Минздрава (№ 720 и др.).
Раздел составлен на основе:
МУК 4.2.734-99 «Микробиологический мониторинг производственной среды»;
приказа МЗ СССР № 720 от 31.07.78 «Об улучшении медицинской помощи больным с гнойными хирургическими заболеваниями и усилении мероприятий по борьбе с внутрибольничной инфекцией».
6.3. Процедура исследования микробной обсемененности поверхностей
В производственных лабораториях бактериологическое исследование микробной обсемененности поверхностей помещений и оборудования проводится с целью проверки эффективности их дезинфекции и направлено на обнаружение общих и термотолерантных колиформных бактерий.
Исследование проводят перед работой методом смыва, не реже одного раза в месяц. Смывы проводят с поверхности рабочих столон на каждом рабочем месте, с дверных ручек, наружных деталей приборов, со стен бокса.
Подготовительный этап
Для контроля используют:
пробирки с 5 мл стерильной 1 %-ной пептонной воды, в пробки которых вмонтированы стерильные ватные тампоны на палочках. Тампоны не должны смачиваться питательной средой;
· среду Эндо проверенной ранее серии (раздел 11).
1 %-ную пептонную воду предварительно проверяют на стерильность. Для этого 2 пробирки от приготовленной партии среды инкубируют при температуре 37 °С в течение 24 часов. Учитывают наличие (отсутствие) пророста среды.
В зависимости от применяемого дезинфицирующего агента в качестве нейтрализатора используют стерильные растворы следующих химических веществ:
· тиосульфат натрия (0,5 %-ный раствор) - при использовании для дезинфекции хлорсодержащих, перекисных, йодосодержащих препаратов. Препарат может быть добавлен в 1 %-ный раствор пептонной воды;
· сульфонол с молоком (на 1 л раствора используют 200 г сульфонола, 100 мл обезжиренного молока и 700 мл дистиллированной воды) - при использовании четвертичных аммониевых соединений;
· мыло банное (0,5 %-ный раствор) - при использовании препаратов на основе анионных поверхностно активных веществ, гибитана;
· водопроводная вода - при использовании препаратов на основе фенола, глютарового альдегида;
· аммиак (0,5 %-ный раствор) - при использовании формальдегида или препаратов на его основе.
Методика контроля
Стерильный тампон, вмонтированный в пробку пробирки, погружают в 1 %-ную пептонную воду. Смоченным тампоном тщательно протирают исследуемую поверхность. При контроле мелких предметов смывы проводят с поверхности всего предмета. При контроле предметов с большой поверхностью смывы проводят с площади не менее 100 см2.
После взятия смыва тампон помещают на 10 - 15 мин в пробирку с раствором нейтрализатора, затем переносят в пробирку с питательной средой, погрузив тампон в пептонную воду.
Контрольные смывы инкубируют при температуре (37 ± 1) °С в течение 18 - 24 часов.
После инкубации проводят высев из 1 %-ной пептонной воды на среду Эндо.
Посевы на среде Эндо и незасеянную чашку среды этой же партии (отрицательный контроль) инкубируют при температуре (37 ± 1) °С в течение 18 - 24 часов.
При отсутствии роста на контрольной чашке и наличии роста в посевах смывов, дальнейшее исследование проводят согласно МУК по санитарно-микробиологическому анализу воды.
Результат заносят в журнал по регистрации микробной обсемененности поверхностей и заверяют подписью исполнителя.
Обнаружение микроорганизмов в смывах с исследуемых поверхностей свидетельствует об их неадекватной дезинфекции. В этом случае, извещают руководителя подразделения и выясняют возможные причины неэффективной дезобработки поверхностей.
Лаборатории центров Госсанэпиднадзора для контроля микробной обсемененности поверхностей руководствуются соответствующими приказами Минздрава (№ 720 и др.), согласно которым предусматривается выявление стафилококка, синегнойной палочки, бактерий группы кишечной палочки и, строго по показаниям, аэромонад.
Раздел составлен на основе:
МУК 4.2.734-99 «Микробиологический мониторинг производственной среды»;
руководства Минздрава России Р 3.1.683-98 «Использование ультрафиолетового излучения для обеззараживания воздуха и поверхностей в помещениях»;
приказа МЗ СССР № 720 от 31.07.78 «Об улучшении медицинской помощи больным с гнойными хирургическими заболеваниями и усилении мероприятий по борьбе с внутрибольничной инфекцией».
6.4. Оценка эффективности ультрафиолетового бактерицидного излучения
Качество обеззараживания воздуха ультрафиолетовым облучением зависит от мощности бактерицидного излучения. Мощность бактерицидного излучения определяется количеством облучателей и эффективностью их функционирования.
В связи с тем, что количество облучателей определяют при организации лаборатории согласно требованиям, предъявляемым к помещениям данного назначения, методика расчета количества установок для ультрафиолетового облучения в настоящем документе не рассматривается. Правильность расчета можно проверить по паспорту на используемый бактерицидный облучатель (УФ-лампы) или согласно руководству МЗ РФ Р.3.1.683-98 «Использование ультрафиолетового излучения для обеззараживания воздуха и поверхностей в помещениях»
В процессе работы мощность потока бактерицидного излучения лампы снижается. В связи с этим при выработке 1/3 ресурса (ресурс лампы указан в паспорте на лампу) время экспозиции необходимо увеличить в 1,2 раза, а после 2/3 номинального срока службы - в 1,3 раза. При выработке гарантированного срока службы лампа подлежит замене, даже если она функционирует.
Для обеспечения качественной работы ультрафиолетовых ламп необходимо:
· фиксировать дату начала эксплуатации, вести учет времени работы лампы, вносить коррективы времени экспозиции и осуществлять замену согласно отработанному ресурсу лампы;
· не менее 1 раза в месяц протирать лампы от пыли. Эффективность ультрафиолетового облучения помещения оценивают по результатам микробной обсемененности воздуха.
Применение ультрафиолетового бактерицидного излучения для обеззараживания воздуха считают эффективным, если уровень микробной обсемененности после облучения не превышает допустимых пределов - пророст не более 3 колоний на чашке при использовании седиментационного метода и не выше 500 КОЕ/м3 при использовании аспирационного метода.
В случаях пророста на чашках более 3 колоний или обсемененности воздуха > 500 КОЕ/м3 выполняют внеплановую генеральную уборку бокса с обработкой всех поверхностей с использованием дезинфицирующих средств и обеззараживанием воздуха ультрафиолетовым облучением.
После окончания мероприятий контроль микробной обсемененности воздуха повторяют.
Если при повторном определении уровень обсемененности воздуха снова превышает нормативы, определяют бактерицидную эффективность облучения.
Бактерицидная эффективность является процентным выражением степени снижения микробной обсемененности воздуха после ультрафиолетового облучения.
Методика контроля
Для расчета бактерицидной эффективности производят определение микробной обсемененности воздуха аспирационным методом, как указано в п. 6.2, до и после облучения. Бактерицидную эффективность рассчитывают по формуле:
БЭ = ((Nд - Nп)/Nд) × 100 %,
где БЭ - бактерицидная эффективность облучения в данном помещении;
Nд - число микроорганизмов до облучения;
Nп - число микроорганизмов после облучения.
· Применение ультрафиолетового бактерицидного излучения для обеззараживания воздуха считают эффективным, если бактерицидная эффективность составляет не менее 99 %.
При получении неудовлетворительных результатов контроля ставят в известность руководителя лаборатории и принимают меры по выяснению причин недостаточной эффективности обеззараживания.
Если установленная бактерицидная эффективность ультрафиолетового облучения в пределах нормы, а микробная обсемененность воздуха превышает нормативы, необходимо выяснить источник контаминации воздуха.
Раздел составлен на основе:
руководства Минздрава России Р 3.1.683-98 «Использование ультрафиолетового излучения для обеззараживания воздуха и поверхностей в помещениях».
6.5. Процедура контроля стерильности фильтровальных установок
Контроль стерильности фильтровальных установок проводят перед началом посева методом мембранной фильтрации.
Подготовительный этап
Для контроля используют:
· плотную полноценную неселективную среду (питательный агар, ГРМ-агар и др.) проверенной ранее серии (раздел 11);
· стерильные мембранные фильтры (нитрат- или ацетат-целлюлозные) для микробиологических целей с диаметром пор 0,45 мкм, проверенной ранее партии (раздел 12);
· стерильную водопроводную воду;
· спирт ректификат 96°-ный.
Накануне исследования питательный агар проверенной серии разливают в чашки Петри слоем не менее 2 мм и проверяют на стерильность. Для этого одну чашку из приготовленной среды инкубируют при температуре 37 °С в течение 24 часов. При наличии роста микроорганизмов приготовленную среду выбраковывают.
Методика контроля
Фильтровальные воронки устанавливают в гнезда фильтровальных столиков. Внутренние поверхности воронки фильтровальной установки смачивают 96°-ным спиртом и фламбируют. После сгорания спирта и остывания воронок одну из воронок снимают. С помощью стерильного пинцета помещают мембранный фильтр на основание держателя фильтра, затем снова присоединяют фильтровальную воронку.
При отключенном вакууме воронку заполняют стерильной водой таким образом, чтобы вода обмыла внутренние стенки воронки. Объем стерильной воды должен составлять не менее половины максимального объема воронки.
Включают вакуум и отфильтровывают содержимое воронки. Вакуум отключают, снимают фильтровальную воронку и стерильным пинцетом переносят мембранный фильтр с основания на чашку со средой. Между мембранным фильтром и поверхностью агара не должно быть пузырьков воздуха. Чашки с посевами переворачивают и инкубируют в термостате при (37 ± 1) °С в течение (24 ± 2) часов.
Рост микроорганизмов свидетельствует о неэффективной обработке фильтровальной установки. Результаты заносят в журнал контроля стерильности фильтровальных установок и визируют подписью сотрудника, выполнившего контроль (прил. 6). Обо всех случаях нестерильности фильтровальных установок ставят в известность руководителя подразделения.
6.6. Процедура контроля обсемененности флаконов для отбора проб
Контролю подвергаются все виды флаконов, используемые для отбора проб: стеклянные многоразового использования после стерилизации и пластиковые одноразового использования, поступающие стерильными от производителя.
Условия проведения испытаний в значительной мере обусловливают качество данного вида контроля. В этой связи его неотъемлемой частью является следующий комплекс мероприятий.
1. Анализ проводят в боксе для разливки сред или в посевных комнатах (боксах) для посева питьевой воды.
2. Непосредственно перед исследованием проводят дезинфекционную обработку помещения (мытье бокса). После дезобработки включают дополнительно бактерицидные лампы на 1,5 - 2 часа.
Спецодежду для проведения анализа (халат, шапочку, четырехслойную марлевую маску) стерилизуют. Режим стерилизации спецодежды: автоклавирование при температуре (120 ± 1) °С в течение 45 минут или при температуре (132 ± 2) °С в течение 20 минут.
Перед входом в бокс сотрудник, проводящий испытания, тщательно моет руки теплой водой с мылом и щеткой, вытирает стерильно полотенцем, одевается в стерильный халат, шапочку, маску, надевает перчатки, обрабатывает их 70 %-ным этиловым спиртом.
При наличии ламинарного укрытия исследование выполняют в спецодежде с использованием стерильных перчаток.
Во время испытаний проводят контроль воздуха на обсемененность в соответствии с процедурой, описанной в п. 6.2. Результаты контроля заносят в протокол испытания.
Контроль обсемененности стеклянных флаконов для отбора проб
Целью проведения данного вида контроля является выборочный контроль качества подготовки посуды в отношении различных по устойчивости микроорганизмов, учитываемых при проведении анализа питьевой воды: контроль на общую обсемененность, контроль на наличие спор сульфитредуцирующих клостридий.
При проведении контроля режимов суховоздушной стерилизации в полном объеме (биологический, термический, химический) с рекомендуемой периодичностью, контроль обсемененности стеклянных флаконов для отбора проб в зависимости от объема стерилизуемых партий проводят не реже 1 раз в квартал.
Для каждого вида анализа отбирают флаконы в количестве 1 %, но не менее 3 от общего количества партии стерилизованной посуды. Партией флаконов считают все флаконы, прошедшие стерилизацию за один цикл работы одного стерилизатора.
В случае получения результата, свидетельствующего о нестерильности хотя бы одного флакона, все партии флаконов, прошедшие обработку в данном стерилизаторе, бракуют. Забракованные партии флаконов подлежат повторной стерилизации. Выясняют возможные причины нарушения стерильности. Проводят комплексную проверку стерилизатора с одновременным использованием химического, термического (в 5 точках) и биологического контроля согласно п. 6.1.
Подготовительный этап
Для контроля используют:
· жидкую полноценную неселективную среду (питательный бульон, ГРМ-бульон и др.), проверенной ранее серии (раздел 11);
· плотную полноценную неселективную среду (питательный агар, ГРМ-агар и др.), проверенной ранее серии (раздел 11);
· железосульфитный агар, приготовленный согласно МУК 4.2.1018-01, либо зарубежные аналоги, предназначенные для определения сульфитредуцирующих клостридий в воде;
· стерильные мембранные фильтры (нитрат- или ацетат-целлюлозные) для микробиологических целей с диаметром пор 0,45 мкм, проверенной ранее партии (раздел 12);
· стерильные чашки Петри диаметром 90 мм;
· стерильную водопроводную воду;
· спирт ректификат 96°-ный для фламбирования;
· спирт ректификат 70 %-ный для дезинфекции.
Питательный бульон предварительно проверяют на стерильность. Для этого 2 пробирки от приготовленной партии среды инкубируют при температуре 37 °С в течение 48 часов - учитывают наличие (отсутствие) пророста среды. При наличии пророста партию бульона выбраковывают. Контроль стерильности питательного агара и железосульфитного агара проводят в процессе исследования путем постановки отрицательного контроля.
Методика контроля
Контроль на общую обсемененность
В исследуемые флаконы вносят питательный бульон в количестве 20 % от объема флакона (например, во флакон 500 мл вносят 100 мл питательного бульона). Флаконы закрывают стерильными резиновыми (силиконовыми) пробками.
Переворачиванием или встряхиванием флаконов трехкратно обмывают всю внутреннюю поверхность флакона, включая пробку. Инкубацию посевов проводят в этих же флаконах при (37 ± 1) °С в течение (48 ± 2) часа. При видимом росте (помутнение бульона) в каком-либо флаконе результат учитывают как «не стерильно». При сохранении прозрачности питательного бульона проводят контроль пророста бульона: из каждого флакона отбирают по 1 мл содержимого, вносят в 2 стерильные чашки Петри и заливают питательным агаром. Параллельно для контроля стерильности используемого питательного агара стерильную чашку Петри заливают тем же питательным агаром (отрицательный контроль). Чашки с посевами инкубируют при температуре 37 °С в течение 48 часов.
Наличие бактериального роста при условии отсутствия роста микроорганизмов в отрицательном контроле свидетельствует о нестерильности флакона. Результаты заносятся в протокол исследования.
Контроль на наличие спор сульфитредуцирующих клостридий
В исследуемые флаконы вносят стерильную водопроводную воду в количестве 20 % от объема флакона (например, во флакон 500 мл вносят 100 мл воды). Флаконы закрывают стерильными резиновыми пробками.
Переворачиванием или встряхиванием флаконов трехкратно обмывают (смачивают) всю внутреннюю поверхность флакона, включая пробку. Фильтровальную установку фламбируют, после чего производят фильтрацию 100 мл стерильной водопроводной воды (отрицательный контроль), затем через другой мембранный фильтр без дополнительного обжига установки фильтруют весь объем смыва с флакона.
Дальнейшие исследования обоих фильтров («смыва» и «контроля») выполняют аналогично по схеме анализа на выявление спор сульфитредуцирующих клостридий по МУК 4.2.1018-01.
Наличие роста колоний сульфитредуцирующих клостридий при отсутствии роста в отрицательном контроле свидетельствует о нестерильности флакона. Результаты заносятся в протокол исследования.
Раздел составлен на основе:
МУ 24-92 Министерства медицинской промышленности «Контроль стерильности материалов первичной упаковки».
7. Контроль качества дистиллированной воды
В микробиологических исследованиях воды дистиллированная вода используется для приготовления питательных сред, различных растворов, мытья лабораторной посуды, заправки паровых стерилизаторов.
Дистиллированная вода, применяемая в микробиологических лабораториях, должна соответствовать требованиям ГОСТ 6709-72 и проходить контроль не реже 1 раза в месяц.
Хранить дистиллированную воду следует в стеклянных или пластиковых бутылях, желательно с нижним сливом, закрытых крышками или пробками.
Примечание. Документы Международного комитета по стандартизации предъявляют более жесткие требования к воде, предназначенной для приготовления питательных сред. Разный состав воды может обусловливать отличия по качеству питательных сред, приготовленных в разных лабораториях или даже в одной и той же лаборатории из обезвоженной среды одной серии одного производителя, и, как следствие, существенные различия в результатах анализа.
В качестве оптимального варианта для приготовления питательных сред, а также реактивов, используемых непосредственно в анализе, предлагается применение бидистиллированной или деминерализованной воды.
Стандарт ISO 7218:1996, а также ГОСТ Р 51446-99 качество воды, предназначенной для приготовления питательных сред, оценивают по удельному сопротивлению, которое должно быть не менее 300000 Ом/см (либо по электропроводности - не более 3 МкС/см).
Об этом необходимо помнить при использовании для приготовления питательных сред дистиллированной воды, полученной с помощью дистилляторов и контролируемой по ГОСТ 6709-72.
При использовании деминерализованной воды необходимо обращать внимание на содержание микроорганизмов, которые могут размножаться на фильтрах, и при прохождении через ионообменник попадать в воду. При высокой контаминации воды микроорганизмами продукты их жизнедеятельности могут оказывать ингибирующее действие на рост исследуемых микроорганизмов. Наиболее адекватным методом контроля в этих случаях является определение общего числа микроорганизмов, выросших на питательном агаре при температуре 22 °С в течение 72 часов.
При приобретении установок деионизированной воды для микробиологических анализов, необходима консультация с производителями в целях выбора способов обработки, предотвращающих вторичное микробное загрязнение воды.
Раздел составлен на основе:
ГОСТ 6709-72 «Вода дистиллированная»;
ГОСТ 51446-99 (ИСО 7218-96) «Микробиология. Продукты пищевые. Общие правила микробиологических исследований»;
ISO 7218:1996 «Микробиология продуктов питания и кормов для животных. Общие правила микробиологических исследований»;
ISO 3696-87 «Вода для аналитических лабораторных исследований. Спецификация и методы испытания»;
ISO 9998:1991(Е) «Качество воды. Методы оценки и контроля микробиологического подсчета колоний в средах с применением тестов качества воды».
8. Требования к подготовке лабораторной посуды
Одним из факторов, оказывающих влияние на результаты проводимых исследований воды, является недостаточная чистота посуды.
Вся лабораторная посуда, вышедшая после проведения исследования (чашки, колбы, пробирки со средами), помешается в специальные биксы или ведра с крышками и обеззараживается автоклавированием при 126 °С в течение 60 мин или 132 °С в течение 20 мин. Категорически запрещается освобождать использованную посуду от содержимого (питательных сред, растворов с посевами) до обеззараживания.
В исключительных случаях допускается обеззараживание кипячением в 2 %-ном растворе пищевой соды или 0,5 %-ном растворе нейтрального моющего средства в течение 60 мин с момента закипания. Кипячение должно происходить в закрытой емкости с полным погружением в раствор.
Отработанные пипетки обеззараживают в высоком сосуде с полным погружением в дезраствор. Продолжительность обеззараживания зависит от применяемого дезсредства.
При выборе методов обеззараживания необходимо руководствоваться санитарными правилами СП 1.2.731-99 «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами». Допускаются также к использованию новые дезинфекционные средства, получившие разрешение Минздрава России на применение. В этих случаях следует руководствоваться рекомендациями производителя.
Для мытья посуды необходимо применять нейтральные моющие средства: лучше всего применять жидкое моющее средство «Прогресс». Допустимо также использовать с этой целью нейтральные синтетические моющие средства, не содержащие биодобавок (например, «Лотос», «Кристалл», «Эра»).
Схема мытья посуды для исследования воды
Для облегчения процесса мытья посуды после автоклавирования обеззараженную посуду следует замочить в 1 %-ном растворе моющего средства «Прогресс» в горячей воде на 1 - 2 часа. Всю посуду тщательно промыть с помощью ершей и щеток. Ополоснуть от моющего средства в проточной водопроводной воде (8 - 10 раз при использовании моющего средства «Прогресс» и до 15 раз при использовании других порошков). Прополоскать в проточной дистиллированной воде 3 - 4 раза. Высушить при комнатной температуре или в сушильном шкафу при температуре 80 - 100 °С.
Перед мытьем обеззараженных пипеток удаляют «ватики», промывают водопроводной водой под давлением и кипятят в 1 %-ном растворе бикарбоната натрия в течение 45 мин, многократно промывают водопроводной, затем дистиллированной водой. Высушивают, вставляют «ватики» и стерилизуют в суховоздушном стерилизаторе в завернутом виде или пенале.
Обработка новой посуды
Новую посуду, предназначенную для бактериологических исследований, моют в 0,5 %-ном растворе моющего средства, ополаскивают проточной водопроводной водой и кипятят в течение 15 - 20 мин в 1 - 2 %-ном растворе соляной кислоты, затем ополаскивают дистиллированной водой.
Проверка качества мытья лабораторной посуды
При обработке и мытье стеклянной лабораторной посуды используются моющие и дезинфицирующие средства, содержащие вещества, которые могут влиять на рост микроорганизмов. Контроль на наличие остаточных количеств моющих средств имеет важное значение.
Контроль чистоты мытья лабораторной посуды осуществляют путем визуального наблюдения и выборочного проведения тестов.
Стекло вымытой и высушенной посуды должно быть прозрачным, без подтеков, пятен и посторонних включений. При ополаскивании вымытой посуды вода стекает равномерно со стенок флаконов, пробирок, по поверхности чашек и пр.
Качество удаления синтетических моющих и моюще-дезинфицирующих средств оценивают по величине рН. Для этих целей используют рН-индикаторную бумагу с шагом измерительного диапазона не более 0,3 ед. Предварительно определяют рН воды, применяемой для ополаскивания посуды на конечном этапе. Контрольные измерения рН проводят путем прикладывания рН-индикаторной бумаги к поверхности вымытого мокрого стекла, прошедшего обработку. Для контроля произвольно выбирают 3 - 10 ед. посуды. Значение рН воды, полученной в результате контроля, должно соответствовать рН дистиллированной воды, примененной для ополаскивания.
Наличие остаточных жировых загрязнений может быть определено с помощью реактива, содержащего Судан III. Для этого внутреннюю поверхность вымытой и высушенной посуды смачивают 3 - 5 мл красящего раствора, распределяют его по исследуемой поверхности в течение 10 с, затем быстро смывают обильной струей воды. На внутренней поверхности посуды не должно оставаться желтых пятен и подтеков.
Приготовление красящего раствора: в 70 мл нагретого до 60 °С 90 %-ного этилового спирта растворяют по 0,2 г измельченной краски Судан III и метилового синего, затем добавляют 10 мл 20 - 25 %-ного раствора аммиака, 20 мл дистиллированной воды и взбалтывают. Раствор годен в течение 6 месяцев.
Методика проверки качества промывки лабораторной посуды от моющих средств и подбора режима мытья посуды при использовании нового моющего средства, рекомендованная ИСО 9998:1991Е, приведена в прил. 12 в качестве справочной информации.
Подготовка посуды к использованию
Лабораторную посуду (флаконы, пробирки, бутылки, колбы) закрывают силиконовыми пробками. Поверх пробки (кроме пробирок) надевают бумажный (из фольги) колпачок. Бумажный колпачок обвязывают вокруг горлышка ниткой или закрепляют резиновым кольцом.
Чашки Петри, пипетки стерилизуют завернутыми в плотную оберточную бумагу или в пеналах.
При использовании специальной лабораторной посуды и расходных материалов (флаконов с завинчивающимися пробками, металлических или силиконовых колпачков, выдерживающих автоклавирование, микробиологических пробок многоразового использования и других материалов) следует руководствоваться рекомендациями производителя.
Стерилизацию лабораторной посуды осуществляют сухим жаром в сушильном шкафу при 160 °С - в течение 2 часов, 180 °С - в течение 60 мин или паром в автоклаве при 1 атм. 121 °С - в течение 30 мин с последующим подсушиванием в сушильном шкафу при отсутствии вакуумной сушки в автоклаве.
После стерилизации посуду хранят до использования в закрытом шкафу или ящиках с крышками не более 10 суток при ненарушенной упаковке или невскрытом пенале.
Пробирки и другую лабораторную посуду до стерилизации следует хранить в чистых коробках или ящиках столов, выложенных чистой фильтровальной бумагой. Сверху подготовленную посуду также следует прикрыть фильтровальной бумагой от пыли и случайной грязи.
Вымытые предметные стекла вытирают чистой салфеткой и помещают в склянку с притертой пробкой со смесью Никифорова (смесь этилового спирта и эфира в соотношении 1:1).
Обработка резиновых пробок
Новые пробки кипятят 30 мин в 2 %-ном растворе бикарбоната натрия, многократно промывают горячей проточной водопроводной водой (кипячение и промывание повторяют дважды). Затем пробки кипятят 30 мин в дистиллированной воде, промывают и высушивают.
Пробки, бывшие в употреблении, после кипячения в 2 %-ном растворе бикарбоната натрия ополаскивают проточной водопроводной водой, кипятят 30 мин в дистиллированной воде, ополаскивают дистиллированной водой, высушивают.
Резиновые пробки для флаконов заворачивают в бумагу или фольгу и стерилизуют автоклавированием.
Раздел составлен на основании:
СП 1.2.731-99 «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами»;
МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского питания и лечебного, их компонентов»;
Инструкции по микробиологическому контролю производства на предприятиях молочной промышленности, 1987;
ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы». - МЗ, 1985;
приказа МЗ РФ № 309 «Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)»;
XI Государственной фармакопеи СССР. - Вып. 2, 1990.
9. Правила приготовления серийных разведений
Разведением для микробиологических исследований служит раствор или суспензия исследуемого образца, смешанные с девятикратным количеством жидкости для разведения - разбавителем.
Приготовление разведений необходимо:
· при исследовании загрязненных вод в целях снижения количества микроорганизмов на единицу объема, для обеспечения возможности наблюдения за их ростом или подсчетом колоний;
· для постановки исследований, требующих количественного учета используемых модельных микроорганизмов, например, при количественной оценке качества питательных сред, мембранных фильтров и т.д.
· Приемлемое для учета число микроорганизмов составляет:
· для метода подсчета колоний на чашках Петри (90 - 100 мм) - от 15 до 300;
· для учета колоний на фильтре (47 - 50 мм) - от 15 до 100 колоний;
· для учета колоний на фильтре (35 мм) - от 15 до 60 колоний.
Важным моментом в процедуре приготовления разведений является равномерность распределения внесенных микроорганизмов по объему разбавителя. Равномерность распределения достигается тщательным перемешиванием полученной смеси. Достичь более качественных результатов позволяет использование специальных приборов-встряхивателей.
В процессе приготовления разведений каждый образец с помощью прибора тщательно взбалтывают в течение 5 - 10 с. Частоту вращения подбирают так, чтобы жидкость, которая образует воронку, не доходила до края пробирки на 2 - 3 см.
Разбавители
В качестве разбавителей при приготовлении разведений используют:
Пептонно-солевой разбавитель
Пептон 1,0 г
Натрий хлористый 8,5 г
Дистиллированная вода 1000 мл
Физиологический раствор
Натрий хлористый 8,5 г
Дистиллированная вода 1000 мл
Для приготовления разбавителя указанные компоненты растворяют в воде, при необходимости, с подогреванием. Доводят рН так, чтобы после стерилизации он был равен 7,0 ± 0,2 при 25 °С. Разливают разбавитель во флаконы. Стерилизуют при 121 °С в течение 20 мин. Помимо перечисленных выше разбавителей, для приготовления разведений исследуемой воды допускается применение стерильной водопроводной воды.
Методика выполнения разведений исследуемой воды
Разведения исследуемого образца воды следует готовить непосредственно перед анализом и использовать для инокуляции не позже 30 мин с момента приготовления. В стерильные пробирки, количество которых соответствует выбранной степени разбавления исследуемой воды, асептически вносят по 9 мл разбавителя. В первую из пробирок, содержащих 9 мл разбавителя, не касаясь стенок пробирки и поверхности разбавителя, пипеткой вносят 1 мл хорошо перемешанной пробы воды, тщательно встряхивают или перемешивают пипетированием.
Приготовленное первое разведение (10-1) содержит в 1 мл суспензии 0,1 мл исходного образца. В следующую (вторую) пробирку, также содержащую 9 мл разбавителя, не касаясь стенок пробирки и поверхности разбавителя, новой пипеткой вносят 1 мл хорошо перемешанного первого разведения исследуемой пробы. Смесь тщательно встряхивают или перемешивают пипетированием. Второе разведение (10-2) в 1 мл суспензии содержит 0,01 мл исходного образца.
Процедуру приготовления разведений продолжают по описанной схеме до получения суспензии с необходимой концентрацией исходного образца.
Методика приготовления суспензий с заданной концентрацией клеток тестовых микроорганизмов
Приготовление суспензий с заданной концентрацией клеток тестовых микроорганизмов осуществляют с использованием оптического стандарта мутности, соответствующего 0,9 - 1 млрд. микробных клеток/мл.
В стерильную стандартную пробирку, прилагаемую к стандарту, вносят 3 - 4 мл разбавителя. Агаровую культуру тестового микроорганизма петлей переносят в пробирку и растирают по внутренней поверхности пробирки, постепенно смешивая с содержащимся в ней разбавителем.
Возможно приготовление бактериальной взвеси методом смыва выросшей культуры со скошенного агара 5 мл разбавителя.
Полученную взвесь микроорганизмов интенсивно встряхивают, добиваясь полного и равномерного распределения клеток. Мутность полученной взвеси сравнивают с мутностью оптического стандарта, который также предварительно тщательно встряхивают.
При визуальном несоответствии мутности приготовленной суспензии стандарту, ее доводят либо добавлением агаровой культуры, либо добавлением разбавителя. После каждого вносимого изменения суспензию тщательно встряхивают.
При совпадении мутности приготовленной суспензии и мутности оптического стандарта считается, что концентрация клеток тестовой культуры в данной суспензии примерно соответствует значению, указанному для данного стандарта (0,9 - 1 × 109 кл/мл).
Для получения суспензии с нужной концентрацией тестового микроорганизма выполняют серийные разведения полученной стандартной суспензии описанным выше способом.
Для контроля правильности приготовления суспензии, правильности выполнения разведений и расчета заражающей дозы проводят контрольный высев. Выполнение контроля разведений и расчета заражающей дозы описаны в разделе 11.4.2.1.
Раздел составлен на основе:
ISO 6887-1983 «Общее руководство по приготовлению разведений для микробиологических исследований».
10. Процедура ведения эталонных бактериальных культур
10.1. Общие положения
Ведение эталонных культур обеспечивает максимальное сохранение типовых свойств штаммов, что достигается соблюдением принципов их культивирования, контроля и хранения.
Основные принципы ведения эталонных бактериальных культур:
· эталонные штаммы следует получать из официально признанной коллекции микроорганизмов;
· количество пассажей тестового микроорганизма на питательных средах с момента его восстановления до момента его целевого использования должно быть, по возможности, минимальным;
· движение культуры с момента ее восстановления после лиофилизации до целевого использования должно быть однонаправленным, т.е. запасы эталонной культуры не должны пополняться за счет (из) запасов рабочей культуры. Нежелательно пополнять запасы рабочей культуры путем получения ее субкультур;
· контроль эталонного штамма на соответствие паспортным данным и отсутствие диссоциации необходимо проводить перед закладкой на длительное хранение и перед восполнением запасов рабочей культуры;
· штаммы с измененными свойствами для дальнейшей работы не используют;
· для целевого использования пригодны культуры эталонного штамма, прошедшие с момента высева со среды для хранения запасов рабочей культуры не более 2 пассажей.
Данный раздел регламентирует вопросы культивирования, хранения и контроля эталонных культур, которые должны использоваться для обеспечения надлежащего качества исследований в практике лабораторий, выполняющих санитарно-микробиологические исследования воды.
Согласно СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности», пункт 3.1.6: «Производственным подразделением предприятий, контролирующим готовую продукцию, разрешается иметь только коллекцию типовых культур, предусмотренных нормативно-технической документацией».
В практике лабораторий, выполняющих санитарно-микробиологические исследования воды, используются следующие эталонные культуры микроорганизмов:
1. E. coli М17-02 как положительный контроль биохимических тестов и отрицательный контроль реактива на оксидазу; для контроля мембранных фильтров; для контроля качества питательных сред по биологическим показателям.
2. Pseudomonas aeruginosa или Pseudomonas fluorescens как положительный контроль реактива на оксидазу.
3. E. coli K12 F+ Str-r для выполнения анализа на колифаги.
4. Фаг MS2 для контроля способности рабочей культуры E. coli K12 F+ Str-r лизироваться специфическим фагом.
Хранение культур осуществляется в соответствии с п. 3.2.12 СП 1.2.036-95. Лаборатория должна иметь разрешение на работу с микроорганизмами III - IV групп патогенности.
С учетом различной технической и материальной обеспеченности лабораторий возможны два варианты ведения эталонных бактериальных культур:
без создания запаса эталонной культуры длительного хранения, не требующий специального оснащения;
с созданием запаса эталонной культуры длительного хранения с применением криоконсервации, который следует рассматривать как оптимальный.
10.2. Ведение эталонных бактериальных культур без создания запаса эталонной культуры длительного хранения
Процесс ведения эталонных культур, в данном варианте, состоит из следующих блоков:
· восстановление и контроль лиофилизированной культуры;
· создание запаса рабочей культуры; хранение в полужидком агаре при 4 - 8 °С;
· восполнение запаса рабочей культуры;
· подготовка культуры для целевого использования;
· контроль видовых и паспортных свойств.
Хранение запаса рабочей культуры в полужидком агаре при 4 - 8 °С не требует специального оснащения, но порождает необходимость восполнения запасов рабочей культуры путем получения ее субкультур на среде хранения каждые 3 месяца.
Дополнительные пассажи через питательные среды могут привести к диссоциации штамма и потере тестовых свойств. Восполнять запас рабочей культуры разрешается только 3 раза (конец 3, 6 и 9 месяцев) с момента его создания. Это ограничивает срок использования эталонной культуры, полученной из 1 ампулы, 1 годом, по истечении которого необходимо вскрыть новую ампулу с тестовой культурой.
Данный вариант культивирования и хранения эталонных культур аэробов и факультативных анаэробов отражен на схеме в прил. 7.1.
10.2.1. Восстановление лиофилизированной эталонной культуры
Оттянутый конец ампулы с лиофилизированной культурой нагревают над пламенем горелки. Влажным концом стерильного ватного тампона прикасаются к нагретой части, в результате чего появляются трещины. Конец ампулы накрывают трехслойной марлевой салфеткой, смоченной 70°-ным этиловым спиртом и хорошо отжатой и обламывают пинцетом.
После вскрытия ампула остается накрытой той же салфеткой в течение 1 - 2 мин. Затем салфетку осторожно снимают и вместе с остатками стекла погружают в дезраствор. В ампулу вносят к 0,3 мл питательного бульона для регидратации. Содержимое ампулы перемешивают, переносят стерильной пастеровской пипеткой или шприцем в пробирку с питательным бульоном и инкубируют при 37 °С в течение 18 - 24 часов. Оставшуюся бульонную культуру E. coli М17-02 используют для оценки степени диссоциации эталонного штамма.
После инкубации из питательного бульона делают высев петлей на скошенный питательный агар в две пробирки. При восстановлении штамма Е. coli K12 F+ Str-r посев осуществляется на скошенный питательный агар, содержащий стрептомицин. Посевы инкубируют при 37 °С 18 - 24 часа.
Одну пробирку с посевом используют для постановки тестов на соответствие полученного штамма видовым, паспортным свойствам. Второй посев на скошенном питательном агаре используют для создания запасов рабочей культуры.
Культура с измененными свойствами в работу не допускается.
10.2.2. Создание запасов рабочей культуры
При удовлетворительном прохождении контрольных тестов культуру со скошенного питательного агара (для Е. coli K12 F+ Str-r - с питательного агара со стрептомицином) засевают уколом в столбик с полужидким агаром. В зависимости от интенсивности работы лаборатории посев проводят в 4 - 7 пробирок, из расчета по 1 - 2 пробирки на 1 месяц работы и в 1 пробирку для восполнения запасов рабочей культуры через три месяца на следующий квартал. Посевы инкубируют 18 - 24 часа при 37 °С. При наличии роста пробирки закрывают резиновыми пробками и закладывают на хранение при температуре 4 - 8 °С.
Одну из пробирок с культурой, предназначенной для восполнения рабочих запасов, маркируют и хранят отдельно. Запасы рабочей культуры желательно хранить в отдельном холодильнике.
10.2.3. Восполнение запасов рабочей культуры
Восполнение запасов рабочей культуры производится в конце третьего, шестого и девятого месяца с момента вскрытия ампулы (каждые 3 месяца).
Для восполнения запасов рабочей культуры используется субкультура на среде хранения, полученная ранее при создании запасов или при очередном их восполнении. Из пробирки с культурой, предназначенной для восполнения запасов, производят посев в питательный бульон. Посевы инкубируют при 37 °С в течение 18 - 24 часов. Оставшуюся бульонную культуру Е. coli М17-02 используют для оценки степени диссоциации.
После инкубации из питательного бульона делают высев петлей в две пробирки со скошенным питательным агаром. При ведении штамма Е. coli K12 F+ Str-r посев осуществляется на скошенный питательный агар, содержащий стрептомицин. Посевы инкубируют при 37 °С 18 - 24 часа.
Один из посевов используют для постановки тестов на соответствие полученного штамма видовым, паспортным свойствам. Второй посев на скошенном питательном агаре используют для восполнения запасов рабочей культуры.
При удовлетворительном прохождении контрольных тестов процедура закладки культуры на хранение осуществляется согласно п. 10.2.2. Восполнение запасов рабочей культуры проводят только 3 раза. По истечении года использования необходимо получить новую эталонную культуру из коллекции микроорганизмов.
10.2.4. Подготовка культуры для целевого использования в анализе
Накануне использования культуру с полужидкого агара высевают на 2 пробирки со скошенным питательным агаром. Е. coli K12 F+ Str-r пересевают на скошенный питательный агар, содержащий стрептомицин. Посевы инкубируют 18 - 24 часа при 37 °С.
Культуру из одной пробирки используют по назначению с предварительной подготовкой согласно методическим документам. Вторая пробирка используется для получения культуры для работы на следующий (второй) день. При необходимости получения культуры тест-штамма на третий день высев снова производят с полужидкого агара.
10.3. Оптимальный вариант ведения эталонных культур
Процесс ведения штаммов в данном варианте состоит из следующих блоков:
· восстановление и контроль лиофилизированной культуры;
· создание запаса эталонной культуры, хранение в условиях крио-консервации;
· создание запаса рабочей культуры;
· подготовка культуры для целевого использования;
· контроль видовых и паспортных свойств.
Данный вариант ведения эталонных культур обеспечивает оптимальные условия для накопления и длительного (3 - 5 лет) хранения эталонной культуры, предназначенной для создания и регулярного восполнения запаса рабочей культуры.
В отличие от широко распространенной методики ведения культур микроорганизмов, основанной на неограниченных последовательных (линейных) пересевах, данная схема ведения сводит до минимума количество пассажей эталонной культуры, проводимых от момента восстановления после лиофилизации до целевого использования. Такой подход позволяет сократить вероятность нежелательных мутаций, ведущих к потере эталонных свойств, или случайного загрязнения. Забракованная линия эталонной культуры может быть в любой момент заменена новой.
Графически оптимальный вариант культивирования и хранения эталонных бактериальных культур аэробов и факультативных анаэробов отражен на схеме и примерном календарном плане манипуляций в прил. 7.2, 7.3.
10.3.1. Восстановление и контроль лиофилизированной культуры
Восстановление и контроль лиофилизированной культуры проводят, как описано в п. 10.2.1.
10.3.2. Создание запасов эталонной культуры
Параллельно с постановкой контрольных тестов из пробирки со скошенным питательным агаром культуру засевают в 2 пробирки с питательным бульоном и инкубируют 18 - 24 часа при 37 °С.
При удовлетворительном прохождении контрольных тестов, в пробирки с ночной культурой добавляют стерильный глицерин в количестве 1/10 от объема культуры. Содержимое тщательно перемешивают и вносят по 1 мл в промаркированные пластиковые криопробирки из расчета 4 - 5 пробирок на каждый планируемый год хранения. Криопробирки с запасом эталонной культуры устанавливают в криобокс (штатив для криопробирок) и закладывают на хранение при температуре - (70 ± 10) °С. Альтернативным вариантом является хранение в жидком азоте при наличии соответствующего оборудования.
Закладку запасов эталонной культуры на длительное хранение осуществляют единожды на весь период ее использования. Запасы эталонной культуры восполнению не подлежат.
Данный блок выполняет задачу накопителя биомассы эталонного штамма, что позволяет избежать необходимости восполнять запасы рабочей культуры за счет повторных пассажей эталонного штамма через питательные среды и удлиняет «срок службы» культуры, полученной из одной ампулы.
10.3.3. Создание запасов рабочей культуры
Температуру криопробирки из запасов эталонной культуры доводят до комнатной температуры. Содержимое аккуратно перемешивают, вносят в пробирку с 8 - 10 мл питательного бульона и инкубируют при 37 °С 18 - 20 часов. После инкубации из питательного бульона выполняют высев в две пробирки со скошенным питательным агаром. Для E. coli K12 F+ Str-r - на питательный агар, содержащий стрептомицин. Посевы инкубируют в термостате (18 - 24) часа при 37 °С. Оставшуюся бульонную культуру Е. coli M17-02 используют для оценки степени диссоциации, как указано в пункте 10.4.1.
Один из посевов на скошенном питательном агаре используют для постановки тестов на соответствие полученного штамма паспортным (типовым) свойствам. Второй посев используют для создания запасов рабочей культуры.
При несоответствии штамма видовым и паспортным свойствам использование культуры не допускается. В этом случае необходимо разморозить еще одну емкость с эталонной культурой и подвергнуть ее аналогичному исследованию.
Если культура снова не прошла контроль, ее снимают с хранения и в дальнейшем не используют. Необходимо получить новую ампулу с эталонной культурой и начать процедуру ведения тестового штамма сначала.
При удовлетворительном прохождении тестов культуру из пробирки со скошенным питательным агаром засевают уколом в 3 - 6 пробирок с полужидким агаром из расчета 1 - 2 пробирки на месяц в зависимости от интенсивности работы лаборатории. Посев инкубируют 18 - 24 часа при 37 °С. Пробирки закрывают резиновыми или силиконовыми пробками и хранят при 4 - 8 °С.
Запасы рабочей культуры создают 1 раз в 3 месяца, используя для этой цели новую пробирку из запаса эталонной культуры. Повторное замораживание размороженной эталонной культуры запрещается. Запасы рабочей культуры желательно хранить в отдельном холодильнике.
10.3.4. Подготовка культуры для целевого использования
Подготовку культуры для целевого использования осуществляют как описано в п. 10.2.4.
10.4. Контроль эталонных бактериальных культур
Постановка контроля включает:
· оценку степени диссоциации культуры Е. coli M17-02;
· проверку видовых свойств бактериальных культур;
· проверку способности Е. coli K12 F+ Str-r лизироваться специфичным фагом MS2;
· проверку культуры Е. coli K12 F+ Str-r на однородность и отсутствие загрязнения фагом.
10.4.1. Оценка степени диссоциации культуры Е. coli M17-02
Из 18-часовой бульонной культуры делают 10-кратные разведения физиологическим раствором. По 0,1 мл из 5-го и 6-го разведений засевают на 2 чашки питательного агара, предварительно подсушенные в термостате. Шпателем посевы распределяют по поверхности агара до полного исчезновения влаги и инкубируют в термостате при температуре (37 ± 1) °С в течение 18 - 24 часов.
Выбирают чашки, на которых выросло от 30 до 100 колоний. Проверку тест-штаммов на диссоциацию производят путем визуального просмотра изолированных колоний на чашках в прямом и косонаправленном свете через бинокулярную лупу или микроскоп на малом увеличении.
В R-форме колонии эшерихий более плоские, большего размера, неправильной формы с неровными краями и шероховатой, матовой поверхностью.
При наличии диссоциации (по размеру, S-R-диссоциация, др.) подсчитывают количество измененных колоний и общее количество просмотренных колоний. Общее количество просмотренных бактерий не должно быть менее 30. Затем рассчитывают процент диссоциации по формуле:

Если процент диссоциированных колоний превышает 25 %, то данная культура не пригодна для дальнейшего использования.
В связи с полиморфизмом колоний для штаммов Pseudomonas aeruginosa и Pseudomonas fluorescens, а также Е. coli K12 F+ Str-r оценка R-S диссоциации не проводится.
10.4.2. Контроль видовых свойств Е. coli M17-02 и Е. coli K12 F+ Str-r
После восстановления лиофилизированной культуры проводится типирование культуры по биохимическим свойствам до вида.
Идентификацию рекомендуется проводить с использованием тест-систем биохимической идентификации семейства Enterobacteriaceae, разрешенных к применению. При этом следует руководствоваться рекомендациями производителя. Правомочна постановка отдельных биохимических тестов.
Перед очередным ежеквартальным созданием запаса рабочей культуры оценку эталонного штамма Е. coli проводят путем подтверждения следующих основных свойств:
· отсутствие оксидазной активности;
· Грам-негативности;
· способности образовывать на среде Эндо характерные темно-красные (малиновые) колонии с металлическим блеском и отпечатком на среде;
· способности утилизировать лактозу до кислоты и газа при температуре 37 и 44 °С в течение 24 - 48 часов;
· способность утилизировать глюкозу до кислоты и газа при температуре 37 °С в течение 24 часов.
Если культура не соответствует видовым свойствам или выявлено наличие посторонних микроорганизмов, то она не пригодна для дальнейшего использования.
10.4.3. Проверка чувствительности Е. coli K12 F+ Str-r к фагу
Способность Е. coli K12 F+ Str-r лизироваться специфичным фагом, являющимся основополагающим свойством тест-культуры, на котором основан метод определения колифагов в воде.
Контроль чувствительности Е. coli K12 F+ Str-r к фагу осуществляется каждый раз, когда из запасов хранения берется новая пробирка с рабочей культурой на полужидком агаре.
Выполнение анализа
Бактериальную взвесь Е. coli K12 F+ Str-r готовят по стандарту мутности, как указано в разделе 9. На 100 мл расплавленного и остуженного до 45 - 49 °С питательного агара вносят 1 мл бактериальной взвеси и разливают в чашки. После застывания чашки на поверхность агара наносят каплю (0,05 мл) суспензии фага (не захватывая хлороформа). Инкубируют при 37 °С 18 - 24 часа. Просмотр посевов следует осуществлять в проходящем свете.
Культура считается восприимчивой и пригодной для проведения анализов воды при наличии четких зон лизиса.
При отсутствии зон лизиса культура не пригодна для использования и подлежит замене.
10.4.4. Проверка культуры Е. coli K12 F+ Str-r на загрязненность фагом
Бактериальную взвесь Е. coli K12 F+ Str-r готовят по стандарту мутности, как указано в разделе 9, вносят в расплавленный и остуженный до температуры 45 - 49 °С питательный агар из расчета 1 мл взвеси на 100 мл агара. Чашку Петри заливают приготовленной смесью, инкубируют при температуре 37 °С 18 - 24 часа.
Посевы просматривают в проходящем свете. Культура должна давать равномерный газон роста. Наличие зон лизиса в контроле свидетельствует о загрязненности культуры фагами.
Загрязненная культура не пригодна для дальнейшего использования.
10.4.5. Контроль видовых свойств Pseudomonas aeruginosa и Pseudomonas fluorescens
Оценку эталонного штамма Pseudomonas aeruginosa и Pseudomonas fluorescens проводят путем подтверждения следующих свойств:
· наличия оксидазной активности;
· Грам-негативности;
· роста на ПБ в виде серебристой пленки на поверхности с образованием кольца сине-зеленого пигмента;
· наличия сине-зеленого пигмента пиоцианина при росте на ПА при 37 °С;
· способности роста на питательном агаре при 42 °С в течение 24 часов (для Pseudomonas aeruginosa);
· способности роста на питательном агаре при 4 °С в течение 24 часов (для Pseudomonas fluorescens) либо при температурном оптимуме, указанном в паспорте.
Если культура не соответствует видовым свойствам, то она не пригодна для дальнейшего использования.
10.5. Культивирование, хранение и контроль эталонных культур бактериофагов
В качестве эталонного штамма для проведения контроля культуры клеток-хозяина при проведении анализа на колифаги используется РНК-содержащий фаг MS2.
Процесс ведения эталонного штамма колифага MS2 состоит из 2 функциональных блоков:
· восстановление лиофилизированной культуры;
· создание запасов эталонной культуры и культуры для целевого использования.
10.5.1. Восстановление лиофилизированной культуры
Оттянутый конец ампулы с лиофилизированными культурами нагревают над пламенем горелки. Влажным концом стерильного ватного тампона прикасаются к нагретой части, в результате чего появляются трещины.
Конец ампулы накрывают трехслойной марлевой салфеткой, смоченной 70°-ным этиловым спиртом и хорошо отжатой, и обламывают пинцетом.
После вскрытия ампула остается накрытой той же салфеткой в течение 1-2 мин. Затем салфетку осторожно снимают и вместе с остатками стекла погружают в дезраствор. В ампулу вносят ≈ 0,5 мл питательного бульона для регидратации.
10.5.2. Создание запасов эталонной культуры фага и культур для целевого использования
Рабочую культуру Е. coli K12 F+ Str-r, хранящуюся на полужидком агаре, засевают в пробирку с 10 мл питательного бульона. Посевы инкубируют при (37 ± 1) °С 18 - 24 часа.
После инкубации 0,1 мл полученной бульонной культуры повторно засевают в 3 - 4 пробирки с 10 мл питательного бульона и помещают в термостат при (37 ± 1) °С. Через 2 часа инкубации в каждую пробирку вносят регидрированную культуру фага MS2, инкубацию продолжают до 18 - 24 часов. После инкубации в пробирки добавляют по 1 мл хлороформа, герметично укупоривают, интенсивно встряхивают и оставляют на ночь в холодильнике.
Пипеткой отбирают бульон над осевшим хлороформом и переносят в стерильные пробирки, добавляют по 1 мл хлороформа, герметично укупоривают, встряхивают и хранят в холодильнике.
Одну пробирку используют для целевого назначения в контроле чувствительности культуры Е. coli K12 F+ Str-r к фагу, согласно п. 10.4.3. Две другие служат запасом эталонного фага.
Активность полученной культуры определяется титром фага. Через год хранения титр фага может снизиться. В этой связи необходимо получить новую культуру или провести определение титра хранящегося фага.
10.5.3. Определение титра фага
Для определения титра фага выполняется серия десятикратных разведений хранящейся бульонной суспензии эталонного фага, как описано в разделе 9.
Бактериальную взвесь Е. coli K12 F+ Str-r готовят по стандарту мутности, как указано в разделе 9, вносят в расплавленный и отсуженный до температуры 45 - 49 °С питательный агар из расчета 1 мл взвеси на 100 мл агара.
По 1 мл каждого разведения эталонного фага вносят в чашки Петри и заливают приготовленной смесью питательного агара и Е. coli K12 F+ Str-r. Посевы инкубируют при 37 °С 18 - 24 часа. Пробирки с разведениями закупоривают резиновыми или силиконовыми пробками и хранят до получения результатов при температуре 4 - 8 °С.
После инкубации просчитывают количество бляшек на чашках. Учету подлежат чашки, на которых отмечается рост 30 - 100 негативных колоний фага.
Для использования допускается культура с титром более 107 - 108.
При получении титра менее 107 фаг можно размножить. Для нарастания титра необходимо повторить описанную процедуру.
После выполнения работ с культурами фагов необходимо провести тщательную обработку помещения дезсредствами и обеззараживания ультрафиолетовым излучением.
Раздел составлен на основе:
бактериологического контроля питательных сред. Методические рекомендации в помощь бактериологам санитарно-эпидемиологических станций и больниц. - Хабаровск, 1979;
методических рекомендаций к контролю питательных сред по биологическим показателям. - М., 1980;
ФС 42-3588-98. Питательная среда для выделения сальмонелл сухая (висмут-сульфит агар), срок действия до 15.10.03;
сборника инструкций по общим методам контроля стерильности, физико-химических свойств, пирогенности, на отсутствие контаминирующих агентов и токсичности медицинских иммунобиологических препаратов. Утв. приказом МЗ СССР № 31 от 13.01.83;
руководства по аккредитации для лабораторий, производящих микробиологическое тестирование;
ISO 10705-1:1995 «Water quality - Deterction and enumeration of bacteriophages - Part 1: Enumeration of F-specific RNAbacteriophages»;
ISO 10705-1:1995 «Water quality - Deterction and enumeration of bacteriophages - Part 2: Enumeration of somatic bacteriophages».
11. Контроль питательных сред
Качество питательных сред является одним из важнейших факторов, влияющих на достоверность результата анализа. Жесткая регламентация приготовления питательных сред и выполнения комплекса процедур внутреннего контроля качества является неотъемлемой частью обеспечения достоверности, а также воспроизводимости и повторяемости результатов количественных микробиологических анализов.
На конечный результат качества готовой питательной среды может оказать влияние множество различных моментов. Поэтому контроль качества питательных сред должен осуществляться на всех этапах технологического процесса, начиная от момента закупки среды до непосредственного использования в анализе и включать следующие этапы:
1. Проверку документации и визуальный контроль питательных сред при их получении.
2. Контроль условий и сроков хранения питательных сред.
3. Контроль питательных сред на этапе приготовления.
4. Контроль биологических свойств питательных сред.
5. Контроль на этапе использования питательных сред.
Данный раздел регламентирует процедуры внутреннего контроля качества питательных сред, которые используются для выполнения текущего производственного и государственного санитарно-эпидемиологического контроля воды по санитарно-микробиологическим индикаторным показателям. Применение питательных сред без подтверждения их качества не допускается. Результаты выполнения процедур контроля качества должны быть документально зафиксированы.
11.1. Проверка документации и визуальный контроль питательных сред
Данный этап контроля позволяет избежать покупки продукции у фирм, не имеющих надлежащих документов, удостоверяющих и гарантирующих ее качество, а также выявить грубые нарушения, возникшие при транспортировании (разгерметизация упаковки, несоответствие внешнего вида обезвоженной среды или отдельных компонентов описанию изготовителя и др.). Контроль осуществляют при каждом поступлении в лабораторию новых сред.
При первом контакте с фирмой производящей и (или) реализующей питательные среды необходимо затребовать копии лицензии на право производства и реализации данных питательных сред. Обязательным условием поставки питательных сред является наличие следующих сопроводительных документов:
1. Копии сертификата соответствия на реализуемую среду.
2. Паспорта отдела контроля организации-изготовителя на реализуемую серию препарата.
3. Инструкции по применению.
Среды импортного производства должны иметь сертификаты качества серии ISO 9000.
При получении питательных сред необходимо проверить целостность упаковки (оценивается визуально) и наличие сопроводительной документации (сертификата соответствия, паспорта, инструкции по применению, этикеток на упаковках).
Сопроводительная документация должна содержать следующую информацию:
· название среды и ее назначение;
· название предприятия-изготовителя;
· номер серии;
· номер протокола контрольных испытаний;
· дата изготовления;
· срок годности;
· состав среды;
· условия хранения;
· рецептура приготовления;
· описание внешнего вида и консистенции сухой и готовой среды;
· условия и длительность хранения готовой среды.
Обо всех обнаруженных отклонениях необходимо сообщить руководителю лаборатории.
11.2. Контроль условий и сроков хранения питательных сред
Данный этап контроля позволяет обеспечить правильность и постоянство условий хранения сред, а также своевременное пополнение их запаса.
Контроль осуществляют 1 раз в неделю или чаще.
Сухие питательные среды и реактивы, если не указаны особые условия хранения, необходимо поместить в сухое, защищенное от света место, с температурой воздуха 10-25 °С.
Материалы, требующие пониженной температуры хранения, необходимо поместить в холодильник с соответствующей степенью охлаждения.
Особое внимание следует уделить сохранению герметичности вскрытых упаковок со средами, так как повышение влажности и комкование сухой питательной среды существенно ухудшает ее качество. Если питательная среда упакована в пакет из ламинированной бумаги и весь объем среды не используется за один раз, то после вскрытия пакета оставшуюся часть среды желательно перенести в чистую сухую емкость оранжевого стекла (или другого светозащитного инертного материала) с плотно закрывающейся крышкой.
Готовые питательные среды хранят при температуре (2 - 8) °С. Срок хранения готовой питательной среды определяется изготовителем.
Сухие питательные среды с истекшим сроком годности, но с не изменившимся цветом и консистенцией, подвергают количественным методам контроля питательных сред по биологическим показателям с целью принятия решения о продлении срока годности.
Все приготовленные среды следует промаркировать с указанием названия среды, а также даты приготовления и срока годности. Дату приготовления питательной среды заносят в журнал (прил. 8.1).
Контейнеры (флаконы) с завинчивающимися крышками более пригодны для продолжительного хранения готовых жидких и плотных питательных сред, нежели чашки Петри или емкости с ватно-марлевыми пробками.
Температуру воздуха в местах хранения питательных сред проверяют 1 раз в неделю. Результаты проверки заносят в журнал регистрации температур.
11.3. Контроль питательных сред на этапе приготовления
Для приготовления питательных сред и растворов, используемых в микробиологическом анализе, допускается применение химических веществ по степени чистоты не ниже ЧДА. Требования к качеству воды для приготовления питательных сред для микробиологических анализов изложены в разделе 7.
При условии, что приобретена продукция надлежащего качества, одним из основных факторов, определяющих качество и дальнейшую пригодность питательной среды, является правильность ее приготовления.
Приготовление сред должно осуществляться со строгим соблюдением рецептуры приготовления и условий стерилизации, определенных изготовителем.
Контроль питательных сред на этапе приготовления включает:
· оценку внешнего вида готовой среды;
· измерение рН готовой среды;
· определение стерильности (отсутствия контаминации) готовой среды;
· постановку качественного контроля биологических свойств среды (раздел 11.4.1).
Контроль питательных сред на этапе приготовления проводят каждую варку.
11.3.1. Оценка внешнего вида готовой среды
Оценку внешнего вида питательной среды проводят визуально.
Цвет, прозрачность и консистенция сухой и приготовленной среды должны быть типичны для данного продукта и соответствовать описанию изготовителя.
Некоторыми очевидными ошибками при приготовлении сред являются:
· потемнение среды, вследствие перегревания и недостаточного перемешивания;
· неполное растворение порошкообразной среды;
· образование осадка.
В агаризованных средах осадок может образовываться вследствие продолжительной стерилизации, повторных плавлений твердого агара или длительного содержания расплавленного агара при высокой температуре.
В этих случаях появление осадка свидетельствует о непригодности питательной среды.
Кроме того, агаризованные среды могут образовывать хлопьевидный осадок, если расплавленная среда остается в водяной бане при температуре от 43 до 45 °С более 30 мин, вследствие начинающегося процесса застывания агара. Такой хлопьевидный осадок агара можно рассеять путем повторного нагревания среды до 60 °С.
11.3.2. Измерение рН
Значение водородного показателя определяют с помощью рН-метра, для агаризованных сред - бумажной индикаторной системы с шагом измеряемого диапазона не более 0,3 единиц. Определение проводят согласно инструкции по использованию прибора или индикаторной системы.
Величину водородного показателя измеряют у стерилизованной среды, а при работе с плотной средой, измеряют у стерилизованной среды после ее отвердения. Результаты регистрируют в журнале (прил. 8.1).
Отклонение рН среды за пределы диапазона указанного в паспорте приводит к ухудшению ее биологических свойств, вплоть до полной непригодности.
Отклонения водородного показателя или другие проблемы с рН могут быть вызваны:
· перегревом;
· недостаточным перемешиванием;
· чрезмерной стерилизацией;
· использованием щелочного стекла;
· загрязнением емкостей, в которых готовилась среда;
· дистиллированной водой низкого качества.
11.3.3. Определение стерильности
Определение стерильности (для стерилизуемых сред) и отсутствия контаминации (для нестерилизуемых сред) проводят путем инкубации чашки или пробирки с исследуемой средой в термостате, при температуре и в течение времени, определенных для этих сред методическими документами по исследованию воды.
По истечении срока инкубации на (в) исследуемых питательных средах должны отсутствовать визуально определяемые признаки роста микроорганизмов.
Результаты регистрируют в журнале (прил. 8.1).
11.4. Контроль биологических свойств питательных сред
Оценка биологических (ростовых) свойств питательных сред проводится по следующим показателям.
Чувствительность - максимальное разведение тестовой культуры, при котором на всех засеянных чашках (во всех пробирках) обнаруживается рост.
Скорость роста - минимальное время инкубации после посева культур, достаточное для визуального выявления роста (выражается в часах).
Дифференцирующие свойства - оцениваются по выраженности основных отличительных признаков, характеризующих рост тестовых штаммов на данной питательной среде.
Кроме того, для дифференциальных сред необходимо определять ингибирующее действие среды. Ингибирующее действие среды определяется как в отношении основного тестового микроорганизма, так и по отношению к сопутствующим микроорганизмам.
Оценка ингибирующих свойств проводится по двум показателям.
Процент извлекаемости - процентное соотношение среднего значения количества колоний, выросших на исследуемой среде, к среднему значению количества колоний, выросших на контрольной среде.
Показатель ингибиции - степень подавляющего воздействия на постороннюю микрофлору, выражается минимальным разведением, при котором полностью отсутствует рост посторонней флоры.
Основным тестовым микроорганизмом для оценки биологических свойств среды, используемых для текущего санитарно-бактериологического контроля воды, является Е. coli.
Дополнительно используются следующие тест-штаммы:
· для выявления дифференцирующих свойств среды - Shigella sonnei «S-form» в качестве вида, не ферментирующего лактозу;
· при определении показателя ингибиции посторонней микрофлоры - Staphylococcus aureus.
Контроль биологических свойств готовых питательных сред включает два этапа: качественный и количественный контроль, каждый из которых имеет свое целевое предназначение.
Задачей качественного контроля является выявление грубых нарушений технологии приготовления, приводящих к выраженному снижению ростовых и(или) дифференцирующих свойств. Качественный контроль проводят после каждой варки среды.
Количественный контроль позволяет выявлять относительные изменения (ухудшение) ростовых свойств из-за ряда причин, возникающих на этапах транспортирования, хранения, приготовления, стерилизации, а также при изменении технологических требований в процессе производства питательных сред, в результате которых они оказываются менее эффективными.
Количественный контроль выполняется:
· при поступлении каждой новой партии среды;
· при необходимости решения вопроса о продлении срока годности среды либо возможности ее дальнейшего использования в случае выявления нарушений условий хранения.
Учитывая, что разные серии питательных сред одного производителя иногда имеют различие по качеству, контролю подлежит каждая серия среды поступившей партии.
Количественный контроль также может служить инструментом выбора более эффективной среды серии продукции, предлагаемой на современном рынке.
11.4.1. Качественный контроль
В процессе качественного контроля оценивают принципиальную способность основного тестового штамма расти на данной среде, а также наличие характерных дифференцирующих признаков для специфических сред.
Качественный контроль выполняется лабораторией после каждой варки питательной среды.
Методика исследования
Накануне исследования тестовую культуру готовят, как указано в п. 10.2.4.
Контроль выполняют путем посева тестового штамма в жидкие, полужидкие или на плотные питательные среды с помощью общепринятых методик. Для плотных сред, метод посева должен обеспечивать получение изолированных колоний микроорганизмов (например, метода «штриха»). Пробирки и чашки с посевами инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов.
Оценка результатов качественного контроля
Среду считают пригодной, если по истечении срока инкубации тестовый штамм дает хорошо различаемый рост, со всеми типичными для него отличительными признаками, которые предполагается выявлять на данной среде.
Этими признаками могут быть: помутнение жидкой или полужидкой среды, изменение цвета, образование газа, отличительная форма, структура, окраска колоний, наличие и диаметр зоны изменения цвета и прозрачности среды вокруг колоний. Результаты качественного контроля заносят в журнал (прил. 8.1).
11.4.2. Количественный контроль
Выполнение количественного контроля должно осуществляться лабораторией, имеющей лицензию на работу с необходимыми патогенными микроорганизмами, аттестованной (аккредитованной) в этой области и располагающей персоналом соответствующей квалификации.
11.4.2.1. Подготовительный этап
Питательные среды
Для исследования следует использовать свежеприготовленные среды одной варки. Исследуемые и контрольные среды готовят, согласно инструкции изготовителя.
Среды, предназначенные для прямого поверхностного посева, разливают в чашки Петри слоем не менее 2 мм, и предварительно асептически подсушивают, одним из следующих способов:
1. Перевернутые чашки Петри с открытыми крышками выдерживают в термостате или сушильном шкафу при температуре 25 - 50 °С до исчезновения капель влаги с поверхности агара. Не пересушивать!
2. Закрытые не перевернутые чашки Петри выдерживают в ламинарном боксе в течение ночи.
3. Чашки Петри с полуоткрытыми крышками помещают в ламинарный бокс на 30 мин.
В качестве неселективной среды при определении ингибирующих и дифференцирующих свойств контролируемой среды, используют мясопептонный агар, питательный агар на основе гидролизата кильки, рыбной муки (ГРМ-агар) и их аналоги.
Разбавитель
Для исследования необходимо использовать стерильный физиологический раствор, содержащий 0,1 % (по массе) пептона. Это сводит до минимума воздействие разбавителя на микроорганизмы. При невозможности приготовления данного разбавителя, допускается использование стерильного физиологического раствора без пептона.
Подготовка инокулята
За два дня до исследования тестовую культуру микроорганизма пересевают со среды хранения на скошенный питательный агар согласно п. 10.2.4. На следующий день, из полученной агаровой культуры с использованием стандарта мутности готовят суспензию тестового штамма в стерильном разбавителе с концентрацией 109 кл/мл и десятикратные серийные разведения (по 8-е разведение включительно), согласно п. 9.
Для контроля разбавления из 6-го и 7-го разведений высевают по 0,1 мл (100 мкл) суспензии прямым поверхностным посевом на чашки с питательным агаром. Из каждого разведения делают по три таких посева. После высева, пробирки с разведениями немедленно переносятся в холодильник. Чашки с посевами инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов.
В день исследования для каждой серии посевов подсчитывают среднее число колоний, выросшее на трех чашках. При правильно выполненном разведении среднее количество колоний выросших при посеве 0,1 мл суспензии тестового микроорганизма из 6-го разведения должно составлять около 100 КОЕ. Соотношение полученных средних значений при посеве из 6-го и 7-го разведений должно быть близко к 10:1.
В случае если, концентрация микроорганизмов в разведениях значительно отклоняется от расчетной и (или) не соблюдена кратность разведения, данный инокулят тестового штамма не пригоден для дальнейшего использования. Подготовку инокулята необходимо повторить.
Для показателей, требующих определения количества внесенных микроорганизмов, рассчитывают посевную дозу. Посевная доза - объем конкретного разведения, содержащий необходимое для посева количество жизнеспособных клеток тестового микроорганизма. Расчет дозы выполняют, основываясь на ранее определенных концентрациях тестового микроорганизма в 6-м и 7-м разведениях, исходя из требований, что посев на одну чашку не должен превышать 50 - 100 микробных клеток. При правильно выполненном разведении посевная доза составляет 50 - 100 мкл суспензии из 6-го разведения.
После расчета посевной дозы определяют необходимое количество повторов посевов (не менее 5) исходя из расчета, что суммарное количество колоний на всех чашках на одной среде должно составлять не менее 200 КОЕ.
Приготовленные суспензии можно использовать, если они были охлаждены сразу же после приготовления и произведения контрольных высевов, и не хранились более 24 часов. Перед исследованием инокулят следует тщательно перемешивать, чтобы добиться однородности суспензии микроорганизмов.
11.4.2.2. Методики посевов
Посев в жидкую питательную среду
Данный метод посева используется при количественном определении показателей ростовых и дифференцирующих свойств жидких и полужидких питательных сред. Суспензию нужного разведения тестовой культуры тщательно перемешивают, чтобы добиться ее однородности. Посевную дозу суспензии асептически помещают при помощи пипетки, в пробирку с исследуемой питательной средой и перемешивают. Инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов.
Посев прямым поверхностным методом
Суспензию нужного разведения тестовой культуры тщательно перемешивают, чтобы добиться ее однородности. Посевную дозу суспензии асептически помещают при помощи пипетки, на поверхность заранее подготовленной питательной среды (п. 11.4.2.1). Стерильным шпателем культуру распределяют по поверхности питательного агара, чтобы добиться равномерного распределения инокулята. После впитывания инокулята чашки переворачивают и инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов.
11.4.2.3. Определение показателей «чувствительности» и «скорости роста»
Методика исследования
При определении показателей чувствительности и скорости роста используют по 0,1 мл из 5, 6, 7 и 8-го разведений для посева на плотные питательные среды и по 1,0 мл из 4, 5, 6, 7-го для посева в жидкие среды. Разведения готовят и контролируют, как указано в п. 11.4.2.1.
Посев каждой дозы инокулята выполняют не менее чем на 3 чашки или пробирки в соответствии с п. 11.4.2.2. Посевы инкубируют при 37 °С в течение 24 часов. Визуальный учет скорости роста культуры в каждом взятом в опыт разведении микробной взвеси производят для плотных сред через 12 и 24, а для жидких - через 3, 6, и т.д. часов инкубации.
Оценка результата
Чувствительностью среды считается наибольшее разведение исходной суспензии тестового штамма с исходной концентрацией около 109 КОЕ/мл, обеспечивающее формирование колоний на всех засеянных чашках или визуально видимый рост во всех пробирках с исследуемой средой.
Чувствительность среды должна соответствовать параметру, указанному изготовителем в паспорте данной среды. Если данный параметр изготовителем не указан, то чувствительность должна составлять не менее чем 0,1 мл суспензии из 6-го разведения для плотных и 1 мл суспензии из 7-го разведения для жидких питательных сред.
При отсутствии роста в одной пробирке или на одной чашке с посевом разведения, указанного в паспорте как чувствительность, опыт повторяется на удвоенном числе пробирок или чашек. Приемлемым считается наличие роста в 5 посевах оцениваемого разведения из 6. Если при повторном исследовании чувствительность среды не соответствует паспортному значению, то ее бракуют.
Скорость роста контрольной культуры - минимальное время инкубации посевов, за которое при соответствующем разведении обеспечен отчетливый видимый невооруженным глазом рост культуры во всех пробирках с жидкими питательными средами (помутнение, наличие пленки, изменение цвета среды) или формирование типичных, легко дифференцируемых колоний на чашках с плотной средой.
Скорость роста не должна превышать время инкубации, указанное в нормативных документах для исследований, в которых эта среда используется.
Результат заносят в протокол оценки питательной среды по биологическим показателям (прил. 8.2).
11.4.2.4. Оценка дифференцирующих свойств среды Эндо и ее аналогов
Для оценки дифференцирующих свойств сред используют два тестовых штамма, отличающихся по основному дифференцируемому признаку ферментации лактозы Е. coli (Lac+) и Shigella sonnei (Lac-).
Подготовка инокулятов
Разведения тестовых штаммов готовят, как указано в п. 11.4.2.1. Посевная доза должна содержать 50 - 100 микробных клеток на чашку, рассчитанная по контрольному посеву.
Методика исследования
Из разведений тестовых штаммов, содержащих исходя из контрольных посевов 500-1000 микробных клеток в 1 мл, готовят 3 смеси:
1. По 1 мл каждого штамма Е. coli (Lac+) и Shigella sonnei (Lac-).
2. По 1 мл штамма Е. coli (Lac+) и разбавителя.
3. По 1 мл штамма Shigella sonnei (Lac-) и разбавителя.
Приготовленные смеси тщательно перемешивают. Из каждой смеси в соответствии с рассчитанной посевной дозой (по 50 - 100 мкл) засевают поверхностным методом не менее чем на 3 чашки с исследуемой средой. Посевы инкубируют при (37 ± 1) °С в течение 18 - 24 часов.
По окончании инкубации учитывают выраженность дифференциальных признаков при росте колоний тестового микроорганизма Е. coli (Lac+), ферментирующего лактозу на исследуемой среде (характерный цвет колоний, среды) и их отсутствие в посевах тестового штамма Shigella sonnei (Lac-), не обладающего способностью к ферментации лактозы.
Оценка результатов
Дифференцирующие свойства среды считают удовлетворительными, если она обеспечивает определенный в паспорте перечень признаков и степень их выраженности у тестового штамма, обладающего искомыми свойствами. Результат заносится в протокол оценки питательной среды по биологическим показателям (форма 2 прил. 6.3).
11.4.2.5. Определение процента извлекаемости (% всхожести)
Этот показатель позволяет выявить и оценить наличие и степень ингибирующего влияния исследуемой среды на Е. coli по сравнению с контрольной средой. В качестве контрольной используют ранее проведенную неселективную среду.
Определение процента извлекаемости (% всхожести) особенно важно для сред используемых в методах прямого количественного подсчета (прямой посев исследуемой воды на чашку или фильтр), где наличие даже относительного ингибирующего влияния среды на искомые микроорганизмы будет искажать результат и снижать чувствительность метода.
Методика исследования
Готовят инокуляты для посева и осуществляют расчет посевной дозы как указано в п. 11.4.2.1. Посев на контрольную и исследуемую среду выполняют прямым посевом согласно п. 11.4.2.2.
Чашки с посевами инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов.
После инкубации подсчитывают количество колоний, выросших на каждой чашке. Общее количество колоний во всех повторах (не менее 5) на контрольной неселективной среде должно быть не менее 200. Вычисляют среднее арифметическое значение количества колоний, выросших на контрольной и исследуемой средах.
Обработка результатов
Процент извлекаемости рассчитывают по формуле:
![]()
где Всх % - процент всхожести на исследуемой среде;
Сис - среднее арифметическое значение количества колоний, выросших на исследуемой среде;
Скс - среднее арифметическое значение количества колоний, выросших на контрольной среде.
Оценка результатов
Среда признается приемлемой при условии, что различие между средними значениями количества колоний на контрольной и исследуемой средах не достоверно. При этом, как правило, % извлекаемости (всхожести) составляет не менее 80 %.
Расчет достоверности различий средних значений количества колоний, выросших на контрольной и исследуемой средах приведен в прил. 10.
Результат заносится в протокол количественной оценки питательной среды по биологическим показателям (прил. 8.2).
В случае получения достоверного различия результатов, исследование повторяют, удваивая количество повторов: не менее 10 чашек с общей численностью количества учитываемых колоний на неселективной среде не менее 400.
11.4.2.6. Оценка показателя ингибиции
Для оценки ингибирующих свойств среды Эндо (и ее аналогов) по отношению к микробам-ассоциантам используют тестовый штамм Staphylococcus aureus.
Подготовка инокулята
Разведения тестового штамма готовят и контролируют, как указано в п. 11.4.2.1.
Методика контроля
Взвесь штамма-ассоцианта из разведений 10-1 (108 микробных клеток в мл) по 100 мкл засевают на 3 чашки Петри с испытуемой и контрольной (неингибиторной) средами. В качестве контрольной среды используется питательный агар. Через 24 - 48 часов инкубации при температуре (37 ± 1) °С определяют число колоний, сформировавшихся на испытуемой и контрольной средах.
Оценка результатов
Ингибирующие свойства среды являются удовлетворительными, если в разведении 10-1 отсутствует рост микроба-ассоцианта при наличии роста в контрольных посевах. Результат заносят в протокол оценки питательной среды (прил. 8.2).
11.4.3. Рекомендации по сравнительной оценке эффективности питательных сред с использованием мембранных фильтров
Основным методом концентрирования в санитарно-бактериологических исследованиях воды - является фильтрование через мембранные фильтры. Введение дополнительного фактора, мембранного фильтра, в систему «микроорганизм-питательная среда» может оказать влияние на показатели роста микроорганизмов и биологические свойства среды.
В настоящее время ведущие зарубежные производители питательных сред выпускают среды, обеспечивающие своим составом оптимальные условия роста микроорганизмов при использовании мембранных фильтров и целенаправленно предназначенные для исследования воды мембранным методом. В отличие от своих аналогов для клинических исследований или прямых посевов воды без концентрирования, эти среды имеют индекс m, например m Endo agar.
В нашей стране подобные среды пока не производятся и в нормативных требованиях к качеству питательных сред такой важный момент, как комплексная оценка системы «микроорганизм-фильтр - среда», не нашел отражения.
Тем не менее, в случаях необходимости сделать выбор между средами, предлагаемыми разными производителями, оценка качества среды в комплексе с используемыми в анализе мембранными фильтрами, наряду с перечисленными в пп. 11.1 - 11.4.2 исследованиями, будет способствовать повышению объективности получаемых результатов, а в отдельных случаях может стать определяющим фактором в принятии решения.
Однозначно признано, что исследования, выполненные на чистых культурах модельных микроорганизмов, не могут учесть влияния всего многообразия микроорганизмов естественных водоемов. В этой связи, при проведении сравнительной оценки дифференцирующих и ингибирующих свойств различных сред, может оказаться полезным использование природной воды для приближения к натурным условиям.
Однако при выполнении этих исследований необходимо всегда иметь в виду наличие индивидуальных особенностей каждого водоема, а также нестабильность во времени как микробиологических характеристик природных вод, так и уровней химического загрязнения. Эти факты существенно снижают важность полученных результатов и ограничивают их применение конкретным водоемом.
С учетом изложенного, описанная методика носит рекомендательный характер.
11.4.3.1. Подготовительный этап
Мембранные фильтры
Процент извлекаемости используемых мембранных фильтров должен составлять не менее 80 % на полноценной неселективной среде. Мембранные фильтры должны быть стерильными.
Питательные среды
Питательные среды для посева мембранных фильтров не подсушиваются, но на поверхности разлитых в чашки сред не должно быть видимой влаги.
Подготовка инокулята
Подготовку инокулята тестовых культур микроорганизма осуществляют как указано в п. 11.4.2.1. В качестве тестовой культуры используют модельный штамм Е. coli M17-02. Посевная доза на фильтр должна составлять от 25 до 100 КОЕ для фильтров диаметром 47 мм и 25 - 60 КОЕ для фильтров диаметром 35 мм.
Расчетное засеваемое общее количество тестовых микроорганизмов должно быть не менее 200, при количестве повторов - не менее 5.
Природная вода используется как естественный источник водных сапрофитов для оценки ингибирующих и дифференцирующих свойств исследуемых сред. За сутки до начала исследований природная вода, предназначенная для подготовки инокулята, должна быть оценена по общепринятым методикам на общее содержание микроорганизмов (ОМЧ) и наличие искомых колиформных микроорганизмов и до начала основных исследований помещена в холодильник.
По результатам выполненных контрольных посевов рассчитывают необходимый объем природной воды. Объем инокулята природной воды должен содержать сотни - тысячи сапрофитных микроорганизмов. Использование обедненных по микробному составу природных вод в данных исследованиях нецелесообразно.
В установленный по содержанию сапрофитных микроорганизмов объем природной воды вносят расчетную посевную дозу тестового микроорганизма (Е. coli).
Если природная вода содержит достаточное количество колиформных бактерий для посева требуемого количества на один фильтр, модельные микроорганизмы не используются. При необходимости, природная вода может быть разведена в 10 и более раз.
11.4.3.2. Посев методом мембранной фильтрации
Суспензию нужного разведения тестовой культуры тщательно перемешивают, чтобы добиться ее однородности. Предварительно рассчитанную посевную дозу суспензии вносят в пробирки, содержащие не менее 10 мл разбавителя. Содержимое пробирок тщательно перемешивают. Количество пробирок, содержащих посевную дозу тестового микроорганизма, должно соответствовать количеству предполагаемых посевов методом мембранной фильтрации.
Фильтровальную установку готовят согласно общепринятым процедурам. Контроль стерильности фильтровальной установки проводят, как указано в п. 6.5. Стерильным пинцетом помещают мембранный фильтр на основание держателя фильтра и присоединяют фильтровальную воронку. При отключенном вакууме прибавляют 20 - 30 мл стерильного разбавителя или стерильной дистиллированной воды. Содержимое пробирки с посевной дозой тщательно перемешивают и асептически переносят в воронку с разбавителем, включают вакуум и отфильтровывают.
Дважды, при включенном вакууме, ополаскивают воронку 20 - 30 мл стерильного разбавителя или стерильной дистиллированной воды.
Вакуум отключают, снимают фильтровальную воронку и стерильным пинцетом переносят мембранный фильтр с основания на питательную среду. Между мембранным фильтром и поверхностью агара не должно быть пузырьков воздуха. Чашки с посевами переворачивают и инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов.
Посев инокулята природной воды осуществляется аналогично описанному выше с коррективами в отношении объема инокулята природной воды, который может быть 10 мл и более. В этом случае вносят соответствующее меньшее количество разбавителя или стерильной дистиллированной воды. Обязательно проводят двойное споласкивание воронки, как указано выше.
11.4.3.3. Методика сравнительных исследований
На первом этапе осуществляют отбор сред по параметрам, описанным в пп. 11.1 - 11.3, 11.4.1 - 11.4.2.4.
На втором этапе отобранные среды оценивают по показателю «процент извлекаемости» с использованием двух способов посевов: прямого (по п. 11.4.2.5) и методом мембранных фильтров. Для каждой исследуемой среды и варианта посева должно быть выполнено не менее 5 повторов. Контролями служат прямой посев (контроль № 1) и посев мембранным методом (контроль № 2) на неселективную среду.
При необходимости могут быть проведены параллельные дополнительные исследования с инокулятом природной воды. Инокуляты природной воды с внесенными тестовыми микроорганизмами (или без них) засевают методом мембранных фильтров на исследуемые селективные среды.
Учет результатов
Рассчитывается среднее количество колоний для каждой среды, способа посева и контрольных посевов. Общее количество колоний тестового микроорганизма на неселективной среде при посеве прямым методом должно быть не менее 200.
Согласно разделу 12 подтверждают качество используемых в эксперименте мембранных фильтров путем расчета «процента извлекаемости» для мембранных фильтров по средним результатам контрольных посевов (прямого № 1 и мембранного № 2) на неселективный агар.
Далее по п. 11.4.2.5 производят расчет процента извлекаемости и оценку достоверности различий для исследуемых сред. Контрольным результатом при этом служит среднее количество колоний, выросших при прямом посеве на неселективном агаре (контроль № 1).
При посевах природной воды с дополнительным внесением тестовых микроорганизмов в дальнейших расчетах учитывают полученные накануне результаты контрольного посева на наличие колиформ. Далее, процент извлекаемости рассчитывается так же, как и в исследованиях с чистыми культурами: в сравнении с результатами прямого посева тестовых микроорганизмов на неселективный агар (контроль № 1).
В случае посевов природной воды без дополнительного внесения тестовых микроорганизмов оценивают достоверность различий результатов, полученных при посевах на исследуемые среды.
При получении недостоверных различий результатов исследований для выбора наиболее оптимальной среды необходимо проанализировать следующие характеристики:
· четкость проявления дифференцирующих признаков для тестового микроорганизма;
· подавление сопутствующей микрофлоры;
· выявление ингибирующего действия микробного населения природной воды на тестовую культуру Е. coli.
11.5. Контроль на этапе использования питательных сред
В процедуре анализа возможны нарушения использования питательных сред (перегрев, чрезмерная инкубация при высокой температуре и т.д.), приводящие к ухудшению их ростовых свойств. Кроме того, возможно неверное толкование полученного результата, вследствие слабой выраженности признака у исследуемого микроорганизма. Контроль на этом этапе позволяет минимизировать подобные проблемы.
Контроль сред на этапе использования включает:
· контроль температурного режима водяных бань, предназначенных для поддержания плотных питательных сред в расплавленном состоянии;
· учет времени нахождения среды в расплавленном состоянии;
· постановку положительного и отрицательного контролей в процессе идентификации микроорганизмов.
Данный вид контроля проводится при каждом использовании питательных сред.
11.5.1. Контроль температурного режима водяных бань, предназначенных для поддержания плотных питательных сред в расплавленном состоянии
Температура водяной бани должна находиться в пределах (47 ± 2) °С.
11.5.2. Контроль времени нахождения питательной среды в расплавленном состоянии
Питательная среда не должна находиться в расплавленном состоянии более 8 часов. Повторное плавление плотной питательной среды не допускается.
11.5.3. Постановка положительного и отрицательного контролей
Постановку контролей осуществляют в процессе идентификации микроорганизмов при выполнении подтверждающих тестов.
Тестовые культуры
В качестве тестовой культуры используют штамм Е. coli М17-02. Подготовка инокулята. Накануне исследования тестовую культуру готовят, как указано в п. 10.2.4.
Методика контроля
Постановку положительного контроля осуществляют путем внесения одной петли агаровой культуры тестового штамма в пробирку с используемой средой (средами) для идентификации. Отрицательным контролем служит пробирка с аналогичной средой без посева. Обе пробирки маркируют и помещают в термостат вместе с посевами.
Учет результатов
По истечении срока инкубации в пробирке с положительным контролем должен наблюдаться хорошо различаемый рост, со всеми типичными для него отличительными признаками, которые предполагается выявлять на данной среде. Цвет индикатора среды должен изменяться на цвет, определяемый в паспорте среды, как положительный результат утилизации данного углевода. В пробирке с отрицательным контролем среда должна находиться без изменений. Результаты положительного и отрицательного контролей заносятся в рабочий журнал основного исследования.
11.6. Ростовые характеристики ряда сред отечественного производства, применяемых в санитарно-бактериологическом анализе воды
ГРМ-булъон, питательный бульон и их аналоги
В качественном контроле среда должна обеспечивать рост тестового штамма Е. coli в виде диффузного помутнения среды не позднее 18 - 24 часов инкубации при (37 ± 1) °С. В количественном контроле среда должна обеспечивать рост тестового штамма во всех пробирках при посеве 1,0 мл из разведения 10-7 не позднее 20 - 24 часов инкубации при (37 ± 1) °С.
ГРМ-агар, питательный агар и их аналоги
В качественном контроле среда должна обеспечивать рост тестового штамма Е. coli в виде бесцветных, прозрачных, круглых колоний в S-форме не позднее 20 - 24 часов инкубации при (37 ± 1) °С. В количественном контроле среда должна обеспечивать рост тестового штамма Е. coli в виде бесцветных, прозрачных, круглых колоний в S-форме на всех чашках при посеве 100 мкл (0,1 мл) из разведения 10-6 не позднее 18 - 20 часов инкубации при (37 ± 1) °С.
Если среду предполагается использовать в качестве контрольной в исследовании по определению показателя ингибиции, то процент всхожести должен составлять не менее 80 % по сравнению со средой ранее проверенной партии, а различие между ними должно быть недостоверно.
Агар Эндос с добавками
В качественном контроле среда должна обеспечивать рост тестового штамма Е. coli в виде красных (малиновых) с металлическим блеском, круглых колоний, диаметром 2,0 - 3,0 мм, с образованием зоны потемнения среды вокруг колонии («отпечатка»), не позднее 20-24 часов инкубации при (37 ± 1) °С.
В количественном контроле среда должна обеспечивать рост типичных колоний Е. coli на всех чашках при посеве 100 мкл (0,1 мл) из разведения 10-6 не позднее 18 - 20 часов инкубации при (37 ± 1) °С.
При посеве смеси тест-штаммов должна наблюдаться четкая дифференциация колоний: в отличие от малиновых колоний Е. coli, колонии шигелл более мелкие с окраской от белого до слабо-розового цвета, без отпечатка на среде.
Среда должна подавлять рост Staphylococcus aureus при посеве 0,1 мл микробной взвеси из разведения 10-1.
Среды с лактозой и глюкозой (жидкие и полужидкие)
В качественном контроле среда должна обеспечивать рост тестового штамма в виде диффузного помутнения среды не позднее 18 - 24 часов инкубации при (37 ± 1) °С. При этом цвет индикатора среды должен изменяться на цвет, определяемый в паспорте среды как положительный результат утилизации данного углевода до кислоты, визуально должно определяться образование газа в виде наполненных и (или) спавшихся пузырьков в толще полужидкой среды или скопления газа в поплавке для жидкой среды.
Количественный контроль для данных сред не проводится.
Железосульфитный агар
Данная среда не выпускается отечественной промышленностью в виде обезвоженного полуфабриката, а готовится из составных частей ex temporo, что исключает возможность ее стандартизации. Это приводит к колебаниям качества среды от варки к варке, что зависит от целого ряда факторов.
Поэтому вопрос о контроле данной среды или ее аналогов на уровне производственной лаборатории остается открытым.
Раздел составлен на основе следующих документов:
международного стандарта ISO 9998:1991(Е) «Качество воды - методы оценки и контроля сред, предназначенных для подсчета колоний микроорганизмов, используемых при тестировании качества воды»;
методических рекомендаций к контролю питательных сред по биологическим показателям. - М., 1980;
бактериологического контроля питательных сред. Методические рекомендации в помощь бактериологам санитарно-эпидемических станций и больниц: МЗ РСФСР. - Хабаровск, 1979;
ФС 42-3377-97 «Питательный агар для культивирования микроорганизмов сухой (ГРМ-агар)»;
ФС 42-3378-97 «Питательный бульон для культивирования микроорганизмов сухой (ГРМ-бульон)»;
ФС 42-3504-97 «Питательная среда для выделения энтеробактерий сухая (агар Эндо)».
12. Контроль эффективности мембранных фильтров
12.1. Общие положения
В практике лабораторий, проводящих санитарно-бактериологический контроль воды, используются мембранные фильтры диаметром 47 или 35 мм и средним размером пор 0,45 мкм.
Мембранные фильтры применяются:
· в анализе на общие и термотолерантные колиформные микроорганизмы;
· в анализе на споры сульфитредуцирующих клостридий.
Качество используемых мембранных фильтров может оказать существенное влияние на результаты анализа. При этом качество мембранных фильтров одного производителя может меняться от партии к партии. При поступлении каждой новой партии фильтров, а также при необходимости принятия решения о возможности продления сроков годности, осуществляется контроль эффективности мембранных фильтров.
При наличии в поступившей партии нескольких серий фильтров, контроль проводится для каждой серии.
Фильтры, допущенные к проведению анализа, используются однократно. Повторное применение мембранных фильтров запрещается.
Принцип метода
Эффективность мембранных фильтров определяется путем сравнения числа колоний микроорганизмов, выросших на полноценной питательной среде в результате прямого поверхностного посева суспензии культуры контрольного микроорганизма, и числа колоний, выросших на этой же среде в результате посева способом мембранной фильтрации.
Оценка эффективности мембранных фильтров осуществляется по показателю «процент извлекаемости». Мембранные фильтры считаются пригодными, если при посеве способом мембранной фильтрации вырастает не менее 80 % от числа колоний, полученных при прямом посеве.
Отбор фильтров для контрольного исследования должен проводиться «слепым» методом, т.е. фильтры для контроля необходимо отбирать произвольно из разных упаковок анализируемой партии.
12.2. Подготовительный этап
Питательные среды
В качестве неселективной среды можно использовать мясопептонный агар, питательный агар на основе гидролизата рыбной муки (ГРМ-агар) и их аналоги. Для выполнения исследования допускаются питательные среды, прошедшие контроль, как указано в разделе 11. Все используемые среды следует готовить из одной партии материалов и реактивов в одно и то же время. Готовую среду разливают в чашки Петри слоем толщиной не менее 2 мм. Чашки со средой, предназначенные для прямого поверхностного посева предварительно асептически подсушивают одним из следующих способов:
1. Перевернутые чашки Петри с открытыми крышками выдерживают в термостате или сушильном шкафу при температуре 25 - 50 °С до исчезновения капель влаги с поверхности агара. Не пересушивать!
2. Закрытые не перевернутые чашки Петри выдерживают в ламинарном боксе в течение ночи.
3. Чашки Петри с полуоткрытыми крышками помещают в ламинарный бокс на 30 мин.
Мембранные фильтры
Исследуемые мембранные фильтры должны быть стерильными.
Тестовые культуры
В качестве тестовой культуры используют штамм Е. coli M17-02.
Разбавитель
Для исследования необходимо использовать стерильный физиологический раствор, содержащий 0,1 % (по массе) пептона. Это сводит до минимума воздействие разбавителя на микроорганизмы. При невозможности приготовления данного разбавителя, допускается использование стерильного физиологического раствора без пептона.
Подготовка инокулята
За два дня до исследования тестовую культуру микроорганизма пересевают со среды хранения на скошенный питательный агар, как указано в п. 10.2.4. На следующий день из полученной агаровой культуры готовят суспензию тестового штамма в стерильном разбавителе с концентрацией 109 кл/мл. Суспензию и необходимые разведения готовят с использованием стандарта мутности, согласно разделу 9. Из 6-го и 7-го разведений (≈ 1000 и 100 кл/мл, соответственно) высевают по 0,1 мл суспензии прямым поверхностным посевом на чашки с питательным агаром. Из каждого разведения делают по три таких посева. Чашки с посевами инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов. После высева пробирки с разведениями немедленно переносятся в холодильник. Срок хранения суспензии в холодильнике до использования в основном исследовании не должен превышать 24 часов.
В день исследования для каждого разведения подсчитывают среднее число колоний, выросшее на 3 чашках и, исходя из полученных результатов, рассчитывают посевную дозу. Посевная доза должна составлять от 25 до 100 КОЕ на чашку или фильтр для фильтров диаметром 47 мм и 25 - 60 КОЕ для фильтров диаметром 35 мм. При правильно выполненном разведении посевная доза, чаще всего, составляет 50 - 100 мкл суспензии из 6-го разведения.
12.3. Методика исследования
Выполняются параллельные посевы суспензий чистой культуры тестового микроорганизма способом мембранной фильтрации через исследуемые мембранные фильтры и прямым (поверхностным) способом.
Необходимо выполнить, как минимум, пять повторов посева каждым способом. Количество повторов должно быть достаточным для обеспечения суммарного значения числа колоний в прямом посеве - не менее 200 КОЕ.
12.3.1. Посев методом мембранной фильтрации
Суспензию нужного разведения тестовой культуры тщательно перемешивают, чтобы добиться ее однородности. Предварительно рассчитанную посевную дозу суспензии вносят в пробирки, содержащие 10 мл разбавителя. Содержимое пробирок тщательно перемешивают. Количество пробирок, содержащих посевную дозу тестового микроорганизма, должно соответствовать количеству предполагаемых посевов методом мембранной фильтрации (не менее 5). После подготовки посевного материала пробирку с разведением культуры тестового микроорганизма, из которой производился отбор посевных доз для посева фильтрацией, немедленно переносят в холодильник.
Фильтровальную установку готовят согласно общепринятым процедурам. Контроль стерильности фильтровальной установки проводят, как указано в п. 6.5. С помощью стерильного пинцета помещают мембранный фильтр на основание держателя фильтра. Присоединяют и, при необходимости, закрепляют фильтровальную воронку. При отключенном вакууме прибавляют 20 - 30 мл стерильного разбавителя или стерильной дистиллированной воды. Содержимое пробирки, содержащей посевную дозу, тщательно перемешивают и асептически переносят в воронку, содержащую разбавитель.
Включают вакуум и отфильтровывают содержимое воронки. В пробирку, ранее содержащую суспензию, вносят 10 мл разбавителя, тщательно перемешивают и отфильтровывают, после чего дважды, при включенном вакууме, ополаскивают воронку 20 - 30 мл стерильного разбавителя или стерильной дистиллированной воды. Вакуум отключают, снимают фильтровальную воронку и стерильным пинцетом мембранный фильтр переносят на чашку с питательной средой (п. 11.2). Между мембранным фильтром и поверхностью агара не должно быть пузырьков воздуха. Посевы инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов.
После инкубации, при условии стерильности фильтровальной установки, подсчитывают количество типичных колоний, выросших на каждом фильтре. Вычисляют среднее арифметическое значение количества колоний, выросших на фильтрах при посеве методом мембранной фильтрации. Результаты заносят в протокол (прил. 9).
12.3.2. Посев прямым поверхностным методом
Для прямого поверхностного посева используют материал из той же пробирки с разведением культуры тестового микроорганизма, из которой производился отбор посевных доз для посева фильтрацией.
Суспензию нужного разведения тестовой культуры тщательно перемешивают, чтобы добиться ее однородности. Предварительно рассчитанную посевную дозу суспензии асептически помещают при помощи пипетки на поверхность питательной среды (п. 11.4.2.1). Выполняют не менее 5 повторов. Стерильным стеклянным шпателем культуру распределяют по поверхности питательного агара, чтобы добиться равномерного распределения инокулята. Чашки переворачивают и инкубируют в термостате при (37 ± 1) °С в течение 18 - 24 часов.
Вычисляют среднее арифметическое значение количества колоний, выросших на чашках при прямом поверхностном посеве. Общее количество колоний во всех повторах должно быть не менее 200 КОЕ. Результаты заносят в протокол (прил. 9).
12.3.3. Расчет «процента извлекаемости» и оценка результатов
Для оценки исследуемых мембранных фильтров вычисляют процент извлекаемости (удержания) мембранных фильтров по формуле:
![]()
где И % - процент извлекаемости (удержания);
СЧмф - среднее арифметическое значение количества колоний, выросших на фильтрах при посеве методом мембранной фильтрации;
СЧч - среднее арифметическое значение количества колоний, выросших на чашках при прямом поверхностном посеве.
Пригодными считаются мембранные фильтры, имеющие процент извлекаемости (удержания) ≥ 80 %.
В случае получения менее 80 % извлекаемости тестового микроорганизма исследования следует повторить с удвоенным количеством повторов (не менее 10), с суммарным учетом по контрольному прямому посеву не менее 400 КОЕ.
12.3.4. Рекомендации по сравнительной оценке эффективности различных мембранных фильтров
Описанная методика может быть использована для сравнительной оценки стабильности качества разных партий фильтров, поставляемых одним производителем, а также мембранных фильтров разных марок разных производителей.
В этих целях выполняются следующие процедуры:
· подготовительный этап по п. 12.2;
· посевы методом мембранных фильтров с каждым видом (серией) фильтров по п. 12.3.1;
· посев прямым поверхностным методом по п. 12.3.2;
· оценка по показателю «процент извлекаемости» по п. 12.3.3.
Проведение дальнейшего сравнения эффективности исследуемых фильтров, показавших приемлемый «процент извлекаемости» ≥ 80 %, осуществляется путем оценки достоверности различия средних значений количества колоний, выросших на мембранных фильтрах разных партий. Достоверность различия средних значений количества колоний оценивают с использованием критерия Стьюдента для вероятности 95 % (прил. 10).
Оценка результатов
Если исследованию подвергались различные партии эквивалентных фильтров, выпускаемых одним изготовителем, то полученные средние значения количества микроорганизмов для каждой партии фильтров не должны отличаться с вероятностью 95 %.
При сравнении мембранных фильтров разных марок, типов или разных производителей выбирают мембранные фильтры, среднее число колоний которых превышает аналогичный показатель для других фильтров с достоверностью 95 %.
Раздел составлен на основе:
международного стандарта ISO 7704-85 «Оценка мембранных фильтров, используемых для микробиологических анализов» («Water quality. Evaluation of membrane filters used for microbiological analyses»).
13. Особенности постановки тестов на этапе идентификации
Идентификация должна проводиться только с чистой культурой. Проведение биохимической идентификации штаммов, выделенных на селективной питательной среде (Эндо или ее аналогах) предпочтительнее проводить с субкультурой, полученной на одной из неселективных питательных сред, не содержащих углеводов (ПА, ГРМ-агар, ПМА). Постановка подтверждающих тестов всегда должна сопровождаться постановкой положительных и отрицательных контролей с эталонными культурами, ферментативная активность которых определена ранее.
Минимальное количество колоний, необходимое для идентификации, указано в нормативных документах на данный вид анализа.
Примечание (информационное)
Достоверность количественного результата повышается с увеличением числа идентифицированных колоний.
В частности, ГОСТ 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов» при необходимости подтверждения характерных колоний требует отбирать не менее 5 изолированных колоний с пересевом для дальнейшей идентификации на неселективную питательную среду.
Французским комитетом по стандартизации АФНОР установлены следующие правила отбора достаточного количества колоний для подтверждения.
Если принять, что n - количество типичных колоний, а n' - необходимое количество колоний для подтверждения, то:
· при n < 5, n' = n;
· при 5 ≤ n < 25, то n' = 5;
· при n ≥ 25, то n' = √n (округленное до общего наивысшего количества).
13.1. Определение Грам-принадлежности
Классический способ определения Грам-принадлежности бактериальных клеток окраской по Граму с последующей микроскопией можно заменить простым и быстрым способом, не требующим оптики - тестом Грегерсена.
Исследования проводят со свежими культурами. Бактериальную массу, взятую с плотной среды, в течение нескольких секунд эмульгируют на предметном стекле в капле 3 %-ного водного раствора КОН. Образование слизи, тянущейся за петлей, указывает на принадлежность испытуемой культуры к грамотрицательным микроорганизмом. Грамположительные микроорганизмы в этой реакции слизь не образуют.
13.2. Постановка оксидазного теста
Используют реактивы, рекомендованные в МУК 4.2.1018-01. Предпочтительно пользоваться готовыми индикаторными системами, изготовленными промышленным способом (например, СИБ-оксидазы, диски оксидазы производства LACHEMA, MERCK, DIFCO).
Надежный результат оксидазного теста может быть получен только при использовании суточной культуры, выращенной на неселективном питательном агаре. Следует иметь в виду, что при постановке оксидазного теста путем наложения мембранного фильтра с выросшими колониями на оксидазный реактив, постановки реакции с колонией, выращенной на среде Эндо, типичные темно-красные колонии могут давать нечеткую реакцию.
Каждый раз при постановке теста (серии тестов) проводят контрольные испытания с тест культурами микроорганизмов, дающих положительную (Pseudomonas aeruginosa) и отрицательную (Е. coli) реакции.
Для постановки реакции используют пастеровскую пипетку или проверенную бактериологическую петлю, не давшую ложных реакций в указанном тесте при испытании с контролируемыми культурами.
Методика постановки
Исследуемую колонию пересевают на скошенный питательный агар. Инкубируют при (37 ± 1) °С в течение 18 - 24 часов. Оксидазный диск слегка смачивают дистиллированной водой / пропитывают реактивом фильтровальную бумагу. Делают мазок культуры на диске с реактивом. Появление окраски не позднее чем через 10 секунд рассматривается как положительная реакция.
При использовании коммерческих тест-систем процедура определения выполняется согласно инструкции.
13.3. Определение ферментации углеводов
Предпочтительно исследовать 18 - 24-часовую субкультуру, полученную на питательном агаре. Для контроля используется жидкие или полужидкие среды, проверенные ранее, как указано в разделе 11. Посев исследуемого штамма осуществляют в среды с углеводами по общепринятым методикам. Постановка положительного и отрицательного контроля осуществляется как указано в пункте 11.6.3. Инкубацию посевов проводят согласно методической документации.
Оценку результатов проводят по окончании срока инкубации путем сравнения изменений в исследуемом посеве с изменениями в положительном контроле. Обязательным условием является отсутствие изменений отрицательного контроля.
Раздел составлен на основе:
ГОСТ 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов»;
стандарта АФНОР NF Т 90-416, 1985;
методических рекомендаций «Обнаружение и идентификация Pseudomonas aerugiosa в объектах окружающей среды (пищевых продуктах, воде, сточных жидкостях)»: МЗ СССР. - М., 1984;
ГОСТ 18963-73 «Вода питьевая. Методы санитарно-бактериологического анализа». - М., 1973;
XI Государственной Фармакопеи СССР. - М., 1998; ИСО 7218-96;
инструкции к ОКСИ-тест(у), Лахема, Чешская Республика;
Определитель бактерий Берджи/Под ред. Дж Хоулта Н. Кинга, П. Снита, Дж. Стейли и С. Уилльямса. - М.: Мир, 1997.
Библиография
1. Бактериологический контроль питательных сред. Методические рекомендации в помощь бактериологам санитарно-эпидемиологических станций и больниц. - Хабаровск: МЗ РСФСР, 1979.
2. Методические указания по бактериологическому контролю качества проведения противоэпидемических мероприятий в акушерских стационарах. Прил. 4 к приказу Комитета здравоохранения г. Москвы и ЦГСЭН в г. Москве № 617/6 от 19.11.98.
3. Руководство по аккредитации для лабораторий, проводящих микробиологическое тестирование. Европейская кооперация по аккредитации лабораторий (EAL), 1996.
4. Руководство по контролю качества питьевой воды. - Т. 1. - ВОЗ. - Женева, 1994.
5. Методы для унификации санитарно-микробиологических исследований воды/Сборник СЭВ: Бад Эльстер, 1979.
6. Унифицированные санитарно-микробиологические методы исследований воды в странах-членах СЭВ/Сборник СЭВ. - М., 1988.
7. Council directive 98/93/EC of 3 November 1998 on the quality of water intended for human consumption. Official Journal of the European Communities. 5.12.98 /Директива Совета Европейского Союза 98/83/ЕС по качеству воды, предназначенной для потребления человеком/.
8. Guidelines for drinking-water quality. - V.2. - WHO. - Geneva, 1996.
9. ISO 3696-87 «Вода для аналитических лабораторных исследований. Спецификация и методы испытания».
10. ISO 8402:1994 (E/F/R) Управление качеством и обеспечение качества. - 2-е изд./Словарь.
11. ISO 6887-1983 «Общее руководство по приготовлению разведений для микробиологических исследований».
12. ISO 7218:1996 «Микробиология продуктов питания и кормов для животных. Общие правила микробиологических исследований».
13. ISO 7704-85 «Оценка мембранных фильтров, используемых для микробиологических анализов» («Water quality. Evaluation of membrane filters used for microbiological analyses»).
14. ISO 8199:1988 «Общее руководство по определению количества микроорганизмов с помощью питательной среды».
15. ISO 9998:1991(E) «Качество воды. Методы оценки и контроля микробиологического подсчета колоний в средах с применением тестов качества воды».
16. ISO 10705-1:1995, «Water quality - Detection and enumeration of bacteriophages - Part 1: Enumeration of F-specific RNA bacteriophages».
17. ISO 10705-1:1995, «Water quality - Detection and enumeration of bacteriophages - Part 2: Enumeration of somatic bacteriophages».
18. NF Т 90-414. AFNOR, 1985.
19. Programme № 100/03. Analyses des eaux. COFRAC SECTION ESSAIS, 1997.
20. Report on Public Health and Medical Subjects № 71. Methods for the Examination of Waters and Associated Materials. Part 1. Drinking Water. The Microbiology of Water, 1994.
Приложение 1
(информационное)
СТРУКТУРА ВНУТРЕННЕГО КОНТРОЛЯ КАЧЕСТВА ПО ОБЪЕКТАМ КОНТРОЛЯ
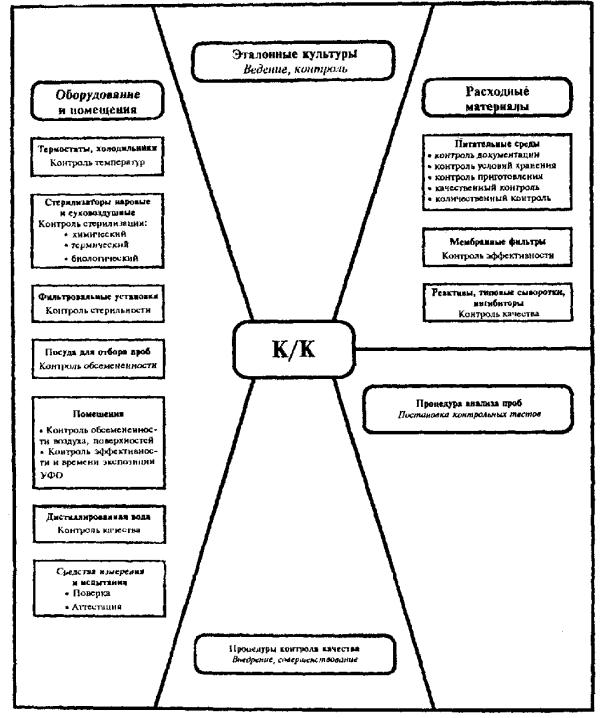
Приложение 2
(информационное)
Структура организации внутреннего контроля качества в лаборатории
|
№ п.п. |
Область контроля |
Периодичность |
|
1 |
Условия проведения испытаний |
|
|
1.1 |
Общие помещения лаборатории «чистой зоны» |
Ежедневно |
|
1.2 |
Уборка и дезобработка помещений «заразной зоны» |
Текущая уборка 2 раза в день, генеральная уборка 1 раз в неделю по графику |
|
1.3 |
Уборка и дезобработка оборудования |
По графику |
|
1.4 |
Воздух боксов, ламинарных укрытий и помещения для фильтрации проб воды на обсемененность |
В дни проведения работ, не реже 2 раз в неделю |
|
1.5 |
Воздушный поток ламинарных укрытий на количество микрочастиц |
1 раз в год |
|
1.6 |
Смывы с поверхностей и оборудования |
Не реже 1 раз в месяц |
|
2 |
Процедура анализа |
|
|
2.1 |
Положительный и отрицательный контроль подтверждающих биохимических тестов при определении: общих и термотолерантных колиформных бактерий, БГКП, фекальных стрептококков, патогенных стафилококков |
Каждый раз при постановке подтверждающих биохимических тестов |
|
2.2 |
Положительный и отрицательный контроль при постановке оксидазного теста |
Каждый раз при постановке теста |
|
2.3 |
Контроль стерильности фильтровальных установок |
В день использования |
|
2.4 |
Контроль качества дистиллированной воды |
1 раз в месяц Внепланово: при нестандартных результатах контроля воды, после проведения ремонта установки, замены фильтров |
|
2.5 |
Контроль мембранных фильтров |
При поступлении новой партии |
|
3 |
Оборудование |
|
|
3.1 |
Средства измерения и испытаний |
Поверка и аттестация по утвержденному графику |
|
3.2 |
Паровые стерилизаторы |
|
|
3.2.1 |
Химический контроль |
При каждой загрузке |
|
3.2.2 |
Термический контроль |
2 раза в месяц |
|
3.2.3 |
Биологический контроль |
2 раза в год |
|
3.3 |
Воздушные стерилизаторы |
|
|
3.3.1 |
Химический контроль |
При каждой загрузке |
|
3.3.2 |
Термический контроль |
2 раза в месяц |
|
3.3.3 |
Биологический контроль |
2 раза в год |
|
3.4 |
Контроль температуры в термостатах |
Ежедневно |
|
3.5 |
Контроль температуры в холодильниках |
Еженедельно |
|
4 |
Контроль стеклянных флаконов для отбора проб на обсемененность |
Не реже 1 раза в квартал при контроле режимов стерилизации |
|
5 |
Питательные среды |
|
|
5.1 |
Проверка документации и визуальный контроль |
При поступлении |
|
5.2 |
Контроль сред на этапе приготовления (рН, внешний вид, стерильность) |
Каждую варку |
|
5.3 |
Качественный контроль ростовых и дифференцирующих свойств |
Каждую варку |
|
5.4 |
Количественный контроль ростовых, дифференцирующих и ингибирующих свойств питательных сред |
При поступлении новых партий (серий) сред При окончании срока реализации среды При выявлении нарушений условий хранения |
|
6 |
Ведение рабочей коллекции эталонных бактериальных культур |
|
|
6.1 |
Создание запаса эталонных культур |
1 раз в 4 - 5 лет |
|
6.2 |
Восполнение запаса рабочих культур |
1 раз в квартал |
|
6.3 |
Подготовка культур для целевого использования |
Ежедневно |
Приложение 3
(рекомендательное)
Лист контроля температурного режима
|
Норматив для данного объекта |
|||
|
Дата |
Значение температуры (°С) |
Заключение |
Подпись |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приложение 4
(обязательное)
ЖУРНАЛ контроля работы стерилизаторов воздушного, парового (автоклава)Код формы по ОКУД Код учреждения по ОКПО |
||
|
МИНЗДРАВ СССР Наименование учреждения Лаборатория |
|
Медицинская документация Форма № 257/у Утв. Минздравом СССР 04.10.80 № 1030 |
|
марка стерилизатора ________________ зав. № стерилизатора ________________ |
||
|
Указать нормативно-техническую документацию (НТД) контроля работы стерилизаторов: 1. _________________________________________________________________________________ 2. _________________________________________________________________________________ 3. _________________________________________________________________________________ 4. _________________________________________________________________________________ 5. _________________________________________________________________________________ |
||
|
Дата |
Подразделение |
Стерилизуемые изделия |
Упаковка |
Время стерилизации (мин) |
Режим |
Тест-контроль |
Заключение* |
Подпись оператора |
|||||
|
Наименование |
Количество |
Начало |
Конец |
Давление |
Температура |
Биолог. |
Термич. |
Хим. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Заполняется ответственным инженером: 1 раз в неделю по результатам химического контроля, 2 раза в месяц по результатам термического контроля. |
|||||||||||||
Приложение 5
(рекомендательное)
Примерная форма регистрации результатов контроля обсемененности воздухаНорма: не более 3 колоний на чашке (аспирационный метод) не более 500 КОЕ/м3 (сендимитационный метод) |
||||
|
Дата |
Комната |
|||
|
точка № 1 на чашке (в 1 м3) |
точка № 2 на чашке (в 1 м3) |
Подпись исполнителя |
Примечания |
|
|
|
|
|
|
|
|
|
|
|
|
|
Приложение 6
(рекомендательное)
Примерная форма регистрации результатов контроля стерильности ФУ
|
Дата |
№ установки |
Подпись исполнителя |
Примечание |
||
|
1 |
2 |
3 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приложение 7.1
(информационное)
Схема ведения культур тестовых микроорганизмов (допустимый вариант)

Приложение 7.2
(информационное)
Схема ведения культур тестовых микроорганизмов (оптимальный вариант)
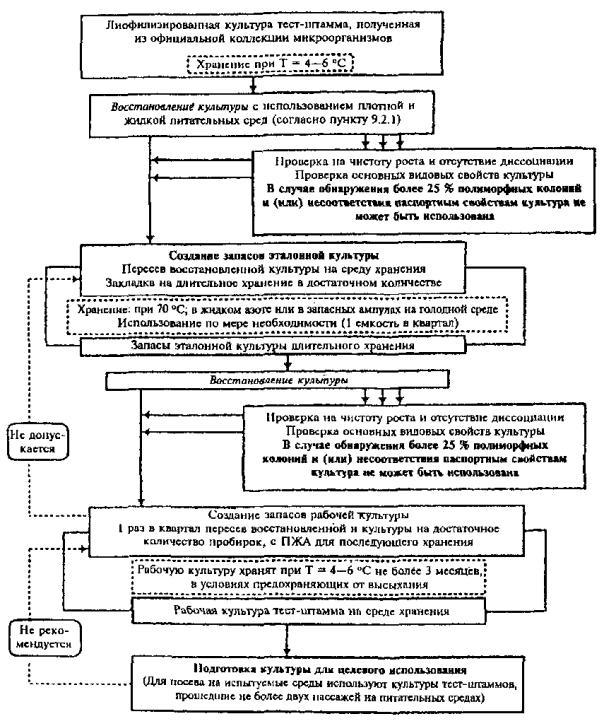
Приложение 7.3
(информационное)
Схема оптимального варианта с примерным календарным планом манипуляций по ведению и контролю тестовых штаммов на 3 - 5 лет
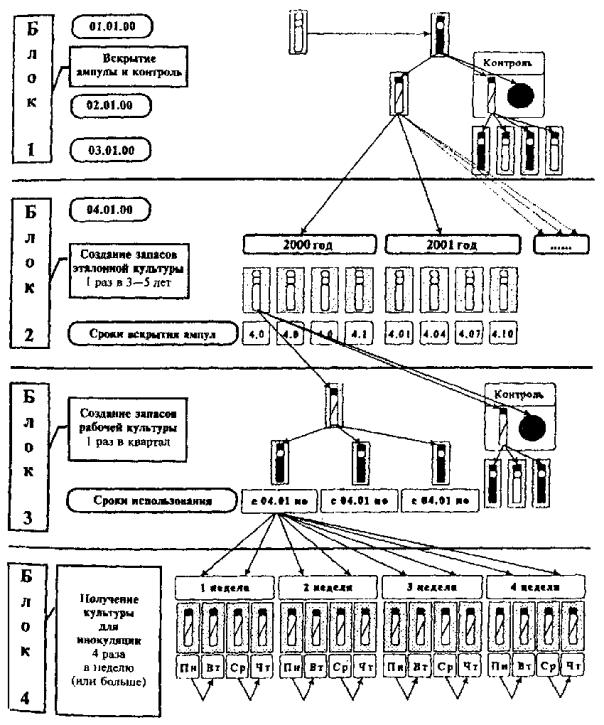
Приложение 8.1
(обязательное)
ЖУРНАЛ
приготовления и контроля питательных сред
|
Код формы по ОКУД Код учреждения по ОКПО |
||
|
МИНЗДРАВ СССР Наименование учреждения Лаборатория |
|
МЕДИЦИНСКАЯ ДОКУМЕНТАЦИЯ Форма № 256/у Утв. Минздравом СССР 04.10.80 № 1030 |
|
Начат «__» _______________ Окончен «__» _____________________ |
||
|
1. При заполнении графы 6 указываются данные о сухих питательных средах, пептоне и т.п. 2. В графах 7 - 11 могут приводиться данные о количестве засеваемых микробных клеток. 3. Для полного учета в журналах ежедневно ведутся записи о количестве приготовленных питательных сред, независимо от проведения контроля. |
||
|
№ п.п. |
Дата приготовления |
Наименование |
Количество приготовленной среды, л |
Серия и дата выпуска препарата, из которого приготовлена среда |
Тесты, применяемые для контроля |
Дата контроля |
Заключение о пригодности |
Подпись исполнителя |
||||
|
РН требуемый |
РН фактический |
Стерильность |
Качественный контроль |
Количественный контроль |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приложение 8.2
(рекомендательное)
Протокол количественного контроля питательных сред
|
Дата выполнения контроля |
|
|
Цель исследования |
|
|
Исполнитель |
|
|
Название исследуемой среды |
|
|
Серия исследуемой среды |
|
|
Название контрольной среды |
|
|
Серия контрольной среды |
|
1. Контроль правильности разведения суспензии тестового штамма
|
Показатель |
Результат |
||
|
Количество колоний при посеве 0,1 мл из 6-го разведения (КОЕ/на чашку) |
|
|
|
|
Среднее количество колоний на чашке при посеве 0,1 мл из 6-го разведения (КОЕ/на чашку) Норма = 100 ± 20 |
|
||
|
Количество колоний при посеве 0,1 мл из 7-го разведения (КОЕ/на чашку) |
|
|
|
|
Среднее количество колоний на чашке при посеве 0,1 мл из 7-го разведения (КОЕ/на чашку) Норма ≈ 1/10 от среднего значения для 6-го разведения |
|
||
|
Заключение |
|||
2. Определение показателей чувствительности и скорости роста
|
|
№ чашки или пробирки |
Условия посева* |
|||
|
|
|
|
|
||
|
Наличие роста** |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
Время появления роста (часы) |
|
|
|
|
|
|
Заключение |
|||||
|
* В жидкие среды засевают по 1,0 мл суспензии из 4, 5, 6 и 7-го разведений. На плотные среды засевают по 1,0 мл суспензии из 5, 6, 7 и 8-го разведений. ** Наличие роста на чашке или в пробирке отмечается знаком «+», отсутствие - знаком «-». |
|||||
3. Определение дифференцирующих свойств среды***
|
*** Определяется только для дифференциальных сред. |
|
|
Признак, определенный в паспорте на среду**** |
Наличие признака у колоний тестового штамма |
|
|
|
|
|
|
|
Заключение |
|
|
**** Наличие признака отмечается знаком «+», отсутствие - знаком «-». |
|
4. Определение % всхожести
|
4.1. Расчет посевной дозы Посевная доза рассчитывается по данным, полученным при определении правильности разведения (п. 1). |
|||||||||||
|
Среднее число КОЕ в 0,1 мл 6-го разведения суспензии тестового штамма |
Посевная доза (мл) |
||||||||||
|
|
|
||||||||||
|
4.2. Расчет % всхожести |
|||||||||||
|
Среда |
Количество колоний |
Среднее к-во колоний |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
|||||||
|
Контрольная среда |
|
|
|
|
|
|
|||||
|
Исследуемая среда |
|
|
|
|
|
|
|||||
|
% всхожести на ИС |
|
||||||||||
|
Достоверность различия ИС:КС по критерию t95 |
|
||||||||||
|
Заключение |
|||||||||||
|
5. Оценка показателя ингибиции |
|||||||||||
|
Среда |
Среднее к-во колоний |
|
|||||||||
|
1 |
2 |
3 |
|||||||||
|
Контрольная среда |
|
|
|
||||||||
|
Исследуемая среда |
|
|
|
||||||||
|
Заключение |
|||||||||||
|
Заключение о пригодности питательной среды |
|||||||||||
Приложение 9
(рекомендательное)
Протокол контроля мембранных фильтров
|
Дата выполнения контроля |
|
|
Исполнитель |
|
|
Название контрольной среды |
|
|
Серия контрольной среды |
|
|
Марка исследуемых фильтров |
|
|
Серия исследуемых фильтров |
|
|
Марка контрольных фильтров* |
|
|
Серия контрольных фильтров* |
|
|
* Заполняется при сравнении мембранных фильтров разных серий одного производителя или фильтров разных производителей. |
|
6. Расчет посевной дозы
|
Посевная доза должна составлять 25 - 100 КОЕ на фильтр диаметром 47 мм и 25 - 60 КОЕ на фильтр диаметром 35 мм. |
|
|
Показатель |
Результат |
|
Количество колоний при посеве 0,1 мл из 6-го разведения (КОЕ/на чашку) |
|
|
Среднее количество колоний на чашке при посеве 0,1 мл из 6-го разведения (КОЕ/на чашку) |
|
|
Посевная доза (мл) |
|
7. Определение % удержания МФ
|
Вид посева |
Кол-во колоний на чашке или МФ |
Среднее к-во колонии |
||||
|
1 |
2 |
3 |
4 |
5 |
||
|
Прямой поверхностный посев |
|
|
|
|
|
|
|
Посев методом фильтрации на исследуемые МФ (ИМФ) |
|
|
|
|
|
|
|
Посев методом фильтрации на контрольные МФ* (КМФ) |
|
|
|
|
|
|
|
% удержания ИМФ |
|
|||||
|
% удержания КМФ |
|
|||||
|
Достоверность различия по критерию t95 |
|
|||||
|
Заключение о пригодности исследуемых МФ |
||||||
|
* Заполняется при сравнении мембранных фильтров разных серий одного производителя или фильтров разных производителей. |
||||||
Приложение 10
(обязательное)
Оценка достоверности различия средних значений с использованием критерия Стьюдента-Фишера
Достоверность различия средних значений количества колоний, выросших на контрольной и исследуемой среде / мембранных фильтрах оценивают с использованием критерия Стьюдента для вероятности 95 %.
Для определения достоверности различия средних величин двух вариационных рядов с использованием критерия Стьюдента, сначала рассчитывают дисперсию для каждого сравниваемого ряда значений, далее вычисляется критерий Стьюдента (t).
1. Определение дисперсии
Дисперсия (σ2) вычисляется по формуле:
![]()
где σ2 - дисперсия;
Σ - знак суммирования;
хп - варианты количества колоний на чашках (фильтрах) на данной среде;
М - среднее арифметическое значение количества выросших колоний;
N - количество посевов в исследовании выполненных на данной среде.
2. Расчет значения критерия Стьюдента
Критерий Стьюдента (t) вычисляется по формуле:
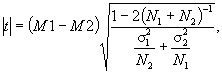
где t - критерий Стьюдента;
М1 и М2 - сравниваемые средние арифметические значения количества колоний;
σ21 и σ22 - дисперсии сравниваемых рядов посевов;
N1 и N2 - количество посевов в исследуемых вариационных рядах.
Для оценки достоверности различия средних величин, полученное значение критерия сравнивается с табличным значением, для числа степеней свободы ν = N1 + N2 - 2 и вероятности 95 %. Таблица значений tp по Стьюденту-Фишеру прилагается. Знак критерия не принимается во внимание.
Если полученное значение критерия больше табличного, то различие между сравниваемыми средними величинами достоверно.
Таблица значений tp (по Стьюденту-Фишеру)
|
Число степеней свободы n' |
Требуемый уровень вероятности доверительного интервала средней р |
|
|
0,95 |
0,99 |
|
|
1 |
12,71 |
63,66 |
|
2 |
4,3 |
9,92 |
|
3 |
3,18 |
5,84 |
|
4 |
2,78 |
4,6 |
|
5 |
2,57 |
4,03 |
|
6 |
2,45 |
3,71 |
|
7 |
2,36 |
3,5 |
|
8 |
2,31 |
3,36 |
|
9 |
2,26 |
3,25 |
|
10 |
2,23 |
3,17 |
|
11 |
2,2 |
3,11 |
|
12 |
2,18 |
3,06 |
|
13 |
2,16 |
3,01 |
|
14 |
2,14 |
2,98 |
|
15 |
2,13 |
2,95 |
|
16 |
2,12 |
2,92 |
|
17 |
2,11 |
2,9 |
|
18 |
2,1 |
2,88 |
|
19 |
2,09 |
2,86 |
|
20 |
2,09 |
2,84 |
|
21 |
2,08 |
2,83 |
|
22 |
2,07 |
2,82 |
|
23 |
2,07 |
2,81 |
|
24 |
2,06 |
2,8 |
|
25 |
2,06 |
2,79 |
|
26 |
2,06 |
2,78 |
|
27 |
2,05 |
2,77 |
|
28 |
2,05 |
2,76 |
|
29 |
2,04 |
2,76 |
|
30 |
2,04 |
2,75 |
|
40 |
2,02 |
2,7 |
|
60 |
2 |
2,66 |
|
120 |
1,98 |
2,62 |
|
Бесконечность |
1,96 |
2,58 |
Приложение 11
(информационное)
Перечень перспективного оборудования для проведения санитарно-микробиологического анализа воды, повышающего качество результатов анализа
|
№ п.п. |
Наименование оборудования |
Применение |
Преимущества |
|
1 |
Магнитные мешалки с регулируемым подогревом до 200 °С |
Приготовление питательных сред |
· Равномерность нагрева способствует сохранению легкоразлагаемых составных компонентов среды · Среды не пригорают, не «убегают» |
|
2 |
Машина для приготовления и розлива питательных сред (во флаконы и чашки Петри) |
Приготовление питательных сред |
· Полная автоматизация процесса · Гарантия стабильного качества питательных сред · Сокращение трудозатрат (при больших объемах) |
|
3 |
Мембранные фильтры современного уровня, характеризующиеся: · оптимальным для бактериологических исследований диаметром пор 0,45 мк · размером 47 - 50 мм в диаметре · наличием сетки на поверхности фильтра · стерильные |
Концентрирование воды |
· Повышение качества получаемого результата · Рост изолированных колоний · Повышение точности и предела обнаружения метода исследования · Повышение точности метода · Обеспечение удобства при учете колоний, повышение точности учета результатов · Сокращение времени на проведение подготовительных работ и фильтрацию проб воды · Отсутствие «отходов» в результате деформации фильтров при стерилизации |
|
4 |
Автоматический счетчик колоний |
Просчет количества колоний на чашках |
· Полная автоматизация процесса · Просчет чашки за несколько секунд · Автоматическая запись результатов |
|
5 |
Установка для получения ультрачистой воды |
Приготовление питательных сред |
· Повышение качества питательных сред · Гарантия отсутствия химических веществ, влияющих на рост микроорганизмов |
|
6 |
Ламинарный бокс |
Выполнение работ по пересеву колоний и культур для идентификации Розлив питательных сред |
· Обеспечение условий стерильности для выполнения работ и предотвращения контаминации исследуемого материала и окружающей среды · Наличие ламинарного бокса приобретает особую актуальность при отсутствии соответствующих боксов для работ по идентификации и розлива питательных сред |
|
7 |
Одноразовая посуда (чашки Петри, пипетки, пробирки и т.д.), одноразовая посуда для отбора проб |
По этапам анализа |
Качество результата, снижение трудозатрат |
|
8 |
Чашки Петри диаметром 55 - 60 мм |
Посев одного фильтра на чашку |
Предотвращение возможности зароста фильтров, расположенных на одной чашке, ведущего к необходимости повторного исследования |
|
9 |
Микроскоп, оснащенный оптикой дифференциально-интерференционного контраста (DIC-оптика) |
Микроскопия препаратов при определении цист лямблий |
Повышение надежности определения цист и качества анализа |
|
10 |
Встряхиватель для пробирок |
На всех этапах, требующих равномерного распределения |
· Равномерность распределения микроорганизмов в суспензии, пробе · Повышение точности количественного результата анализа |
|
11 |
Термостаты с вентиляцией и программированием режимов инкубации |
Инкубация посевов |
· Обеспечение требуемых характеристик поддержания заданной температуры · Возможность перевода в заданный период на задаваемый режим, в т.ч. температуру холодильника (сокращение трудозатрат по оценке результатов в выходные дни) |
|
12 |
Газовые лабораторные горелки со сменными газовыми баллончиками, газовые факелы для фламбирования воронок для фильтрации |
При отсутствии централизованной подачи газа в лаборатории |
(в отличие от спиртовок) · Обеспечивают регулируемое пламя и температуру горения · Упрощают технику проведения анализа · Обеспечивают зону стерильности при фильтрации проб |
|
13 |
Питательные среды импортного производства для определения термотолерантных колиформ |
Определение термотолерантных колиформ методом мембранных фильтров |
Позволяют получать результат через 18 - 24 часа инкубации в термостате при температуре 44 °С |
|
14 |
Питательная среда SPS (зарубежного производства) |
Определение спор сульфитредуцирующих клостридий |
· Готовая среда промышленного производства · Унификация метода |
|
15 |
Питательные среды на подложках (импортные производители) |
Все анализы |
· Не требует приготовления сред · Унифицируют проведение анализа · Позволяют получать результаты высокого качества |
|
16 |
Реактив на определение оксидазы, (импортные аналоги СИБ) |
При постановке оксидазного теста |
Получение быстрого, четкого ответа при постановке реакции |
|
17 |
Бактериологические автоматизированные анализаторы |
Замена классических бактериологических анализов |
Возможность получения ответа в более короткие сроки, сокращение трудозатрат |
|
18 |
Биохимические системы идентификации · с учетом результатов по кодовой книге · автоматизированные |
Проведение идентификации до вида |
Повышение надежности результата, исключение субъективизма исследователя, сокращение трудозатрат |
|
19 |
Очиститель воздуха от микробных аэрозолей |
Вспомогательное оборудование для обеспечения требуемого качества помещений для бактериологического анализа |
Способствует предотвращению загрязнения исследуемой пробы на этапах анализа |
|
20 |
Устройство для забора воздуха аспирационным путем |
Забор воздуха для контроля обсемененности |
Повышение надежности результата |
|
21 |
Автоматизированный регистратор температур (термостатов, холодильников) |
Контроль температурного режима |
Повышение объективности контроля, круглосуточная регистрация температурного режима для оценки его влияния на результаты анализа и работы оборудования |
|
22 |
Автоматические пипетторы (с аккумулятором) |
При работе с пипеткой в бактериологической лаборатории |
Предотвращение контаминации посевного материала, безопасность исследователя, удобство в работе |
|
23 |
Мобильный адсорбционный шкаф при работе с летучими химическими веществами (хлороформом) |
При невозможности установки стационарного вытяжного шкафа |
Безопасность работы, бесшумность |
|
24 |
Водяные бани с регулятором температуры |
Поддержание температуры сред и растворов |
Качество анализа, снижение трудозатрат |
|
25 |
Низкотемпературный холодильник (-70 °С) |
Длительное хранение культур |
Качество результата анализа |
|
26 |
Лабораторная посудомоечная машина (западных производителей) |
Мытье посуды |
Качественное мытье лабораторной посуды |
|
27 |
Автоклавы с программируемыми режимами работ |
Стерилизация сред и посуды деструкции отработанного материала |
Качество питательных сред, оптимальная организация и безопасность работ |
|
28 |
Сухожаровые шкафы с программируемыми режимами работ |
Стерилизация материалов |
Оптимальная организация работ |
|
29 |
Электронный счетчик клеток (типа Stat Count) |
Качественный и количественный гидробиологический анализ |
Сокращение трудозатрат, повышение точности учета численности гидробионтов |
Приложение 12 (справочное)
Приведено по ISO 9998:1991(Е)
Приложение к ISO 9998:1991(Е) (нормативное)
Тест на остатки ингибиторов на лабораторной посуде
Введение
Некоторые смачивающие агенты или детергенты, используемые при мытье лабораторной посуды, могут содержать бактериостатические или ингибирующие вещества, для полного удаления следов которых и для обеспечения полной чистоты от остатков бактериостатического действия требуется от 6 до 12 последовательных ополаскиваний. Выполняйте этот тест раз в год и перед тем, как пользоваться вновь поставленным детергентом. Если пользоваться предварительно вымытой и стерилизованной пластиковой посудой, необходимо проверить ее на остатки ингибиторов.
Порядок действий
Соблюдая обычные правила мытья лабораторной посуды, вымойте 6 чашек Петри и обозначьте их как группу А. Точно так же вымойте 6 чашек Петри, прополощите их 12 раз свежими порциями дистиллированной воды и обозначьте как группу Б. Прополощите шесть чашек Петри водой с добавкой детергента в обычной концентрации и высушите их, не ополаскивая. Обозначьте как группу В.
Чашки Петри всех трех групп простерилизуйте так, как это обычно делается. Для проверки предварительно стерилизованной пластиковой посуды создайте группу Г из шести стерильных чашек Петри.
Добавьте не более 1 мл микробной взвеси, содержащей от 50 до 150 КОЕ, и действуйте в соответствии с процедурой, описанной для подсчета организмов при гетеротрофном посеве (ISO 8199). Если получить подходящий образец трудно, сделайте посев, равный 0,1 мл, в три чашки из каждой группы, а в другие три чашечки каждой группы - посев, равный 1,0 мл.
Интерпретация результатов
Различия средней численности колоний в посевах в чашках групп А, Б, В и Г, составляющие менее 15 %, показывают, что детергент не токсичен и не имеет ингибирующих характеристик или предварительно стерилизованные чашечки пригодны для проведения исследований.
Если среднее количественное выражение численности колонии в посуле группы А по меньшей мере на 15 % ниже аналогичного показателя для посуды группы В, то посуда группы А и после промывки содержит остатки ингибиторов. Если среднее количественное выражение колонии в посуде группы Г по меньшей мере на 15 % ниже аналогичного показателя для посуды группы Б, то в прошедшей предварительную стерилизацию чашечке содержатся остатки ингибиторов.
Различие между средними величинами, полученными при подсчете колоний в посуде групп А и Б, составляющее менее 15 %, и аналогичное различие между колониями в посуде групп А и В, составляющее более 15 %, указывают на то, что детергент обладает ингибирующими свойствами, которые устраняются при стандартном мытье лабораторной посуды.